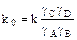
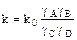
Константа реальная (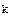 ) не является постоянной, так как зависит от ионной силы раствора (μ), а следовательно зависит и от концентрации. Реальная константа постоянна при постоянной ионной силе раствора (μ=0).
) не является постоянной, так как зависит от ионной силы раствора (μ), а следовательно зависит и от концентрации. Реальная константа постоянна при постоянной ионной силе раствора (μ=0).
Каждая реакция может быть охарактеризована только одной (для данной температуры) термодинамической константой, несколькими реальными константами равновесия В справочниках обычно приводятся термодинамические константы равновесия (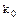 ).
).
Для идеальной системы 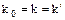 .
.
В реальных системах может быть два случая:
1. Ионная сила раствора больше нуля (т.е. в системе имеется электростатическое взаимодействие) и отсутствуют конкурирующие реакции.μ>0, 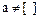 ,
, 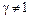 ,
, 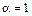 ,
, 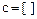 ,
, 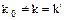 .
.
2. Есть электростатическое и химическое взаимодействие (т.е. протекает конкурирующая реакция). μ>0, 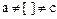 ,
, 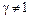 ,
, 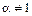 ,
, 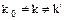 .
.
Если константа химического равновесия высока, то реакция смещена в право, в сторону образования продуктов реакции, следовательно, при меньшей концентрации анализируемого вещества можно получить аналитический сигнал, т.е. реакция будет более чувствительной.
Константа равновесия может принимать следующие значения: больше, меньше или равна единице. В аналитической химии необходимо, чтобы константа была больше единицы.
ЛЕКЦИЯ № 3
 2014-02-02
2014-02-02 6152
6152

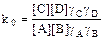
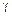 -
- 






