Существует три вида констант химического равновесия.
Скорость химической реакции пропорциональна произведению действующих масс (активности или концентрации).
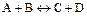
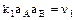
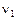 - скорость прямой реакции,
- скорость прямой реакции,
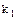 - константа скорости прямой реакции.
- константа скорости прямой реакции.
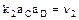
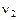 - скорость обратной реакции,
- скорость обратной реакции,
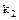 - константа скорости обратной реакции.
- константа скорости обратной реакции.
Константа скорости – это скорость химической реакции при активностях реагирующих веществ равных единице. Это величина постоянна для данной реакции. Она зависит от природы реагирующих веществ, растворителя, а также от температуры и давления. Эта постоянная не зависит от активностей реагирующих веществ.
В момент химического равновесия 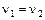 . Следовательно
. Следовательно 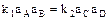 .
.
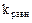 тоже постоянная.
тоже постоянная.
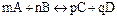 , где m, n, p, q ≠ 1
, где m, n, p, q ≠ 1
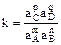
При условии химического равновесия отношение произведений активности продуктов реакции к произведению активности исходных веществ в степенях их стехиометрических коэффициентов есть величина постоянная при данной температуре и давлении и называется константой равновесия. Константу химического равновесия можно представить в виде термодинамической константы 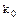 (
(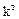 ), константы реальной
), константы реальной 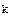 (
(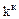 ) (концентрационная константа) и константы условной
) (концентрационная константа) и константы условной 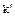 (
(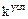 ).
).
|
|
|
Константа термодинамическая есть константа равновесия, выраженная через активности.
Термодинамическая константа (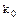 ) есть величина постоянная, которая зависит от природы реагирующих веществ, растворителя, температуры, давления, не зависит от активностей реагирующих веществ при установившемся химическом равновесии.
) есть величина постоянная, которая зависит от природы реагирующих веществ, растворителя, температуры, давления, не зависит от активностей реагирующих веществ при установившемся химическом равновесии.
Для реакции 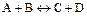
Константа реальная 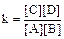 .
.
Константа условная 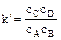 .
.
 2014-02-02
2014-02-02 26136
26136

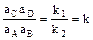 -
- 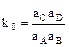 .
.






