Применение железа, кобальта и никеля и их соединений
Соединения железа (VI)
Соединения железа (VI) – оксоферраты, соли железной кислоты – кристаллические вещества, обычно красного цвета. В свободном состоянии железная кислота и соответствующий ей оксид не выделены.
Оксоферраты – очень сильные окислители, окисляют хром (III) до хрома (VI):
2K2FeO4 + Cr2(SO4)3 + H2SO4 = Fe2(SO4)3 + K2Cr2O7 + K2SO4 + H2O
и аммиак до азота:
2K2FeO4 + 2NH3·H2О = 2Fe(OH)3 + N2 + 4KOH.
Оксоферраты термически нестабильны и при небольшом нагревании разлагаются:
4K2FeO4 = 4KFeO2 + 2K2O + 3O2.
Образуются при взаимодействии соединений железа (III) с сильными окислителями:
Fe2O3 + 3KNO3 + 4KOH = 2K2FeO4 + 3KNO2 + 2H2O,
2Fe(OH)3 + 3Br2 + 10KOH = 2K2FeO4 + 6NaBr + 8H2O.
Чистое железо применяется в качестве катализатора и для изготовления магнитных лент.
Более 90 % всего производимого железа используется в виде сплавов чугуна и сталей. Сплавы железа – основа большого количества конструкционных материалов.
Никель и кобальт также используются в виде сплавов. Никель используется в качестве декоративно-защитных покрытий, из него изготавливаются детали химической и электровакуумной аппаратуры. Кобальт и никель применяются в качестве катализаторов в органическом синтезе.
Оксиды железа используются в качестве сырья для доменного процесса, как пигмент в составе красок и эмалей.
Оксиды кобальта и никеля являются сырьем в производстве катализаторов, применяются в качестве компонента твердых электролитов, пигментов для керамики, стекла и фарфора.
Нитраты железа (II) и (III) применяются в качестве коагулянтов в процессе очистки сточных вод, протравы для крашения шерсти.
Хлорид железа (III) используется в качестве катализатора в органическом синтезе, в процессе травления печатных плат, применяется в аналитической химии.
Сульфат железа (II) применяется в качестве компонента электролита в гальванотехнике, в сельском хозяйстве для борьбы с вредителями.
Комплексные соединения железа с неорганическими лигандами используются в цветной фотографии.
Соли кобальта (II) используются в качестве пигментов.
Соли никеля (II) применяются для получения катализаторов и термочувствительных красок.
Задача 1. Запишите уравнения реакций между следующими веществами:
а) кобальтом и концентрированной серной кислотой (при нагревании);
б) никелем и концентрированной азотной кислотой (при нагревании);
в) железом и расплавом хлората калия в щелочной среде.
Решение:
А) Кобальт реагирует с концентрированной серной кислотой при нагревании с образованием сульфата кобальта (II) и сернистого газа:
Co + 2H2SO4 = CoSO4 + SO2 + 2H2O.
Б) Никель реагирует с концентрированной азотной кислотой при нагревании с образованием нитрата никеля (II) и оксида азота (IV):
Ni + 4HNO3 = Ni(NO3)2 + 2NO2 + 2H2O.
В) Железо взаимодействует с щелочным расплавом хлората калия с образованием феррата железа:
Fe + KClO3 + 2KOH = K2FeO4 + KCl + H2O.
Задача 2. При прокаливании 37,45 г гидроксида железа (III) получили твердый остаток. Вычислите объем соляной кислоты с массовой долей HCl 20 % (плотность раствора 1,1 г/мл), необходимый для растворения полученного вещества.
Дано:
m (Fe(OH)3) = 37,45 г
ω (HCl) = 20 %
ρ (р-ра) = 1,1 г/мл
M (Fe(OH)3) = 107 г/моль
M (HCl) = 36,5 г/моль
Найти:
V (р-ра HCl)
Решение:
Запишем уравнение реакции разложения гидроксида железа (III):
2Fe(OH)3 = Fe2O3 + 3H2O. (1)
Твердый остаток – оксид железа (III), реагирует с соляной кислотой согласно уравнению реакции:
Fe2O3 + 6HCl = 2FeCl3 + 3H2O. (2)
Вычислим количество вещества гидроксида железа (III), которое подвергли разложению:
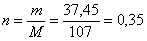 (моль).
(моль).
По уравнению реакции (1) при разложении 2 моль гидроксида железа (III) образуется 1 моль оксида железа (III), следовательно, при разложении 0,35 моль гидроксида железа (III) образуется 0,175 моль (0,35 · ½) оксида железа (III). По уравнению реакции (2) для растворения 1 моль оксида железа (III) необходимо 6 моль соляной кислоты, а на растворение 0,175 моль – 1,05 моль (0,175 · 6) кислоты. Определим массу кислоты:
m (HCl) = n (HCl) · M (HCl) = 1,05 · 36,5 = 38,325 (г).
Тогда:
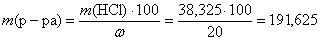 (г).
(г).
Определим объем раствора 20 %-ной соляной кислоты, необходимый для взаимодействия:
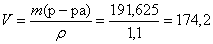 (мл).
(мл).
Ответ: V (р-ра HCl) = 174,2 мл.
 2014-02-02
2014-02-02 4076
4076
