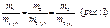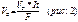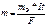Величина электродного потенциала метала зависит от следующих факторов:
1) от природы метала;
2) от температуры;
3) от давления;
4) от равновесной концентрации гидроцированых ионов метала в растворе. Даная зависимость выражается уравнением Нернста.
Е Ме/Меn+ = E0Ме/Меn+ + RT/nF*ln[Меn+-m H2O]
F — постоянная Фарадея F=96500 Кл.
Если подставить все значения поставных для стандартных условий то уравнений будет:
|
Из последнего уравнения Нернста можна записать уравнение для расчёта водородного электрода помещённого в кислату щёлочь или воду.
EH2/2H+=E0H2/2H+ + 0,059/n * lg [H+]
pH= - lg[H+]
|
= -0,059*7 = -0,413 (В)
В гальваническом элементе электроды могут быть изготовлены не из различных металлов, а из одного и того же метала, эти электроны будут погруженными в одном элементе по в разности концентрации, такие элементы называются разно концентрационными.
Примечание: Анодом всегда является электродом опущенным в более разбавленный раствор, т.е. раствор с меньшей концентрацией.
№39.Расчет ЭДС гальванического элемента.
Эффективность работы гальванического элемента характеризует величина ЭДС элемента. ЭДС гальванического элемента, рассчитывается по разности катода и анода. ЭДС = Eкатод – Eанод.
ЭДС всегда должна быть величина постоянная. Чем дальше стоят металлы электродов гальванического соединения, тем больше величина ЭДС при одинаковых концентрациях электродов. Если электроды погружены в однополярные растворы своих солей то их электронные потенциалы раствора…
ЭДС = Eкатод – Eанод = +0,118В
ЭДС = 0,059/n * lg c1/c2 — расчёт ЭДС концентрационного гальванического элемента.
Примечание: Анодом всегда является электродом опущенным в более разбавленный раствор, т.е. раствор с меньшей концентрацией.
№40.Электролиз. Электролиз расплавов. Напряжение разложения. Перенапряжение.
Электролиз окислительный восстановительной процесс протекает при прохождении постоянного электролиза через раствор или расплав электролита. Для осуществления электролиза к отрицательному полису внешнего источника постоянного тока присоединяются электрод на котором будет происходить процесс восстановления катода, а к противоположном к полюсу подсоединяя. электрод на котором будет происходить процесс окисления (т.е. анод) и оба эти электрода погружают в водный раствор или раствор электролита. Материал из которого изготовлены электроды должен проводить электрический ток. В качестве электродов могут использоваться либо металлические электроды, либо другие металлы., но проводящие электрический ток. При электролизе энергия электрического тока превращается в химическую энергию т.е. происходит процесс обратный процессу в гальваническом элементе. Но как и в случае гальванического элемента на катоде идёт реакция восстановления, а на аноде окисления. Во всех электрохимических процессах на аноде окисления всегда, а на катоде всегда восстановления. При электролизе анод имеет знак плюс, а катод знак минус — отличие.
Характер протекания электродных процессов пи электролизе зависит от состава электролита, материала электролитов, а также от режима электролиза. Катодное восстановление при электролизе т.е. реакции на катоде могут идти:
а) Восстановительные катионов до свободных атомов или молекул.
Ni2+ —2e = Ni0
2H+ —2e = H2↑
б) Засечет восстановления молекул воды из электролита:
2H2O +2e = H2↑+2(OH)
№41.Электролиз водных растворов электролитов с инертными электродами.
При электролизе различают два вида электродов:
1) Инертные электроды (не растворимые и не активные электроды). Эти электроды не расходуются в процессе электролиза их назначение проводить электрический ток, электролиз происходит у поверхности этих электродов. Инертные электроды изготавливаются чаще всего из угля, графита или из благородных металлов: платано, золото серебро.
2) Активные электроды — эти электроды сами участвуют в процессе электролиза и расходуются в процессе электролиза. Растворимыми электродами могут быть металлы средней активности или неактивными металлами. Растворимым при электролизе является анод.
Существует три правила катодного восстановления при электролизе.
I правило:
Если электролизу подвергается водный раствор соли не активного метала, метала стоящего в ряду напряжений после водорода, то на катоде восстанавливаются катионы этого метала.
Cu2+ —2e = Cu0
Men+ —2e = Me0
II правило:
Если электролизу подвергается водный раствор соли метала высокой активности, металлы: литий, алюминий то на катоде происходит восстановление волы и выделяется водород.
2H2O+2e=H2 ↑ + 2(OH)
Катионы Men+ в этом случае не восстанавливаются т.к. потенциал их восстановления намного больше чем потенциал восстановления воды.
III правило:
Если электролизу подвергается водный раствор соли метала средней активности (после Al до H) то на катоде происходит две реакции, восстановление катионов метала и восстановление молекул воды.
Men+ +ne = Me0
2H2O +2e = H2↑ +2(OH) -
Анодное окисление при электролизе идёт по двум правилам:
1) Правило:
Если анод кислотный остаток без кислородной кислоты, в своём составе, анион, не содержит атомов кислорода.
Cl -, Br -, I - , S 2- кроме F –
То на аноде окисляются эти анионы:
S2- —2e = S0
2Cl- —2e = Cl2↑
2) Правило:
Если анионы содержат в своём составе кислород, например NO2 -,
NO3 -, SO4 2- и другие и фторид ионы (F -) то на аноде идёт реакция окисления воды с выделением кислорода.
2Н2О — 4e= O2↑ +4H+
№42.3аконы Фарадея. Выход вещества по току.
Количественные характеристики процессов при электролизе регулируются или устанавливаются двумя законами Фарадея.
Законов Фарадея два:
|
t — время
Q — количества электричества; Q = I*t
I — сила тока в Амперах;
Кэ — коэффициент, он равен массе вещества выделяющегося при электролизе при прохождении электричества.
2) При прохождении одинакового количества электричества через растворы или расплавы различных электролитов массы веществ выделяющиеся на электродах, пропорциональны их эквивалентным массам этих веществ или электролитическим эквивалентам. Рис:1
|
установлено что для
выделения при электролизе
одной эквивалентной массы
|
пропустить 96500 Кл электричества.
F =96500 Кл — постоянная Фарадея.
|
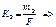
Если на электроде при электролизе выделяется газообразное вещество, то тогда закон Фарадея можно записать в следующем образе: рис:2
На практике при электролизе почти всегда выделяется меньше вещества чем это следует из расчётов Фарадея. Причиной такого явления является то что наряду с основными процессами могут идти побочные (или параллельные) процессы.
Показателем эффективности использованием электроэнергии при электролизе является выход по току η «это». Это отношение фактически выделившегося, к теоретически рассчитанному:
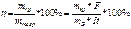 — выход потока для твёрдых веществ
— выход потока для твёрдых веществ
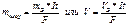
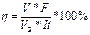 — для газа
— для газа
№43.Электролиз с растворимым анодом. Практическое применение электролиза.
Расплавы солей отличаются от расплавов солей тем что у них абсолютно нет воды т.к. соли плавятся гораздо выше 1000, катионы металлов высокой активности (щелочной метал и щелочноземельные металлы) не способны не способны восстанавливаться из водных растворов солей могут быть восстановлены из расплавов этих солей. Свободный фронт газообразный, анионы которого химическим путём окислить невозможно получают электролизом расплавов фторида металлов.
Пример: Рассмотрим электролиз расплавов соли К и F.
KF - K: K+ + e = K0
- K ← K+ + F - → A + + A: 2F - - 2e = F2
Если электролизу подвергается расплав содержащий катионы различных металлов, то последовательность их восстановления определяется величиной электродных потенциалов этих металлов. В первую очередь восстанавливаются катионы самого неактивного метала, а потом по возрастанию активности.
Практическое применение электролиза
Первое применение электролиза это использование для получения металлов. При получении металлов из раствора солей этот метод называется гидроэлектрометалургический способ получения металлов. Получение металлов из расплава солей называется пироэлектрометалургиеческой, этим способом получаются щелочные и щелочноземельные. Более широкое применение в технике имеет электролиз с растворимым анодом этот способ электролиза применяется при рафинировании металлов при гальваностегии и при гальванопластики.
Электрофинирование металлов — электролитическая очистка металлов. Рафинирование производится как расплавы металлов так и расплавы не металлов, чаще всего очищаются от меди и олова. Чаще всего подвергаются уже очищенные металлы.
Гальванопластика — это получение точных металлических копий с различных предметов обычно неметалл. В гальванопластике применяют обычно не металлический катод, но на поверхности катода наносят тонко проводимый слой, а затем слой антаангизива (вещество которое препятствует метала к катоду). В качестве анода будет метал из которого хотят получить металлическую копию.
№44.Сухой гальванический элемент Лекланше.
Начало формы
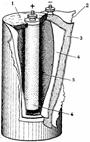 Лекланше элемент, гальванический элемент, в котором положительный электрод изготавливается из двуокиси марганца с добавкой графита и сажи, отрицательный — из цинка. Л. э. был предложен в 1865 французским химиком Ж. Лекланше (G. Leclanche) и первоначально состоял из цинкового стаканчика, заполненного водным раствором хлористого аммония или др. хлористых солей (электролит), с помещенным в него агломератом из двуокиси марганца с угольным токоотводом. В более поздних конструкциях «сухих» Л. э. электролит стали загущать крахмалистыми веществами. Начальное напряжение такого Л. э. — 1,4—1,6 в, конечное — 0,7—0,9 в, удельная энергия (w) 30—50 вт · ч/кг. В 30 — 40-х гг. 20 в. были разработаны Л. э. галетной конструкции с w 40—60 вт · ч/кг. В 60-х гг. появились Л. э. со щелочным электролитом — раствором едкого кали (1,4—1,66; 0,9—1,0 б; w 60—90 вт · ч/кг), которые стали постепенно вытеснять Л. э. с солевым электролитом. Л. э. — наиболее дешёвые и удобные химические источники тока: они хорошо сохраняются, транспортабельны, не требуют специального ухода, всегда готовы к действию. Широко применяются для питания переносной радиоаппаратуры, карманных фонарей, электрочасов, электроигрушек и т. п.
Лекланше элемент, гальванический элемент, в котором положительный электрод изготавливается из двуокиси марганца с добавкой графита и сажи, отрицательный — из цинка. Л. э. был предложен в 1865 французским химиком Ж. Лекланше (G. Leclanche) и первоначально состоял из цинкового стаканчика, заполненного водным раствором хлористого аммония или др. хлористых солей (электролит), с помещенным в него агломератом из двуокиси марганца с угольным токоотводом. В более поздних конструкциях «сухих» Л. э. электролит стали загущать крахмалистыми веществами. Начальное напряжение такого Л. э. — 1,4—1,6 в, конечное — 0,7—0,9 в, удельная энергия (w) 30—50 вт · ч/кг. В 30 — 40-х гг. 20 в. были разработаны Л. э. галетной конструкции с w 40—60 вт · ч/кг. В 60-х гг. появились Л. э. со щелочным электролитом — раствором едкого кали (1,4—1,66; 0,9—1,0 б; w 60—90 вт · ч/кг), которые стали постепенно вытеснять Л. э. с солевым электролитом. Л. э. — наиболее дешёвые и удобные химические источники тока: они хорошо сохраняются, транспортабельны, не требуют специального ухода, всегда готовы к действию. Широко применяются для питания переносной радиоаппаратуры, карманных фонарей, электрочасов, электроигрушек и т. п.
Элемент Лекланше.
1 – воск,
2 – бумажная оболочка,
3 – цинковый цилиндр,
4 – пористая перегородка,
5 – электролит,
6 – угольный стержень, окруженный окисью марганца.
Конец формы
В связи с широким распространением и применением существует множество конструкций данного элемента. Приведем некоторые из них:
№45.Свинцовый аккумулятор.
Аккумулятор — это устройство в котором химическая энергия окисления восстановительных реакций превращается в электрическую энергию, а электрическая вновь превращается в химическую энергию.
Аккумулятор обратимый гальванический элемент. Аккумулятор представляет собой устройство содержащая электролит со специальным электродами. Сначала через это устройство пропускается постоянный электрический ток, происходит электролиз, в результате чего одного из электродов подвергается окислению, а другой восстановлению (зарядка аккумулятора).
Заряженный аккумулятор работает как гальванический элемент (разрядка). Зарядка и разрядка могут повторятся многократно. В зависимости от используемого электролита различают два типа аккумулятора кислотные и щелочные. К кислотным относятся свинцовые аккумуляторы. Свинцовый аккумулятор состоит из решетчатых свинцовых пластин один из которых заполнены диоксидом свинца (Pb O2), а другие металлическим губчатым свинцом. Пластины погружены в раствор серной кислоты 35% – 40%
Концентрации. При работе аккумулятора, при его разрядке в нём протекает окислительно – восстановительная реакция в ходе которой металлический свинец окисляется, а диоксид свинца восстанавливается.
Реакция: 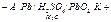
- А: Pb0 -2e +SO2- = PbSO4
+ К: PbO20 -2e + SO42- +4H+ = PbSO4 + 2H2O
Pb2 + PbO2 +2H2SO4 = 2PbSO4 + 2H2O
Электроны отдаваемые свинцом принимаются диоксидом свинца при восстановлении. Электроны передаются от одного электрода к другому по проводу. Во внутренней цепи при работе аккумулятора происходит перенос. Направление этого движения обусловлено электрическим полем. У анода расходуется анионы а у катода катионы. В итоге раствор остается электро нейтральным.
ЭДС заряженного аккумулятора ≈ 2 вольта, по мере разрядки аккумулятора материалы его расходуются, расходуются и серная кислота. При снижении напряжения аккумулятор подлежит зарядке
Для зарядки аккумулятор подключается к источнику внешнего постоянного тока, при этом ток происходит через аккумулятор в направлении обратно тому что происходит при разрядке.
Зарядка:
- К (Pb): PbO2SO4 +2e = Pb + SO42-
+ A (PbSO4): PbSO4 +2H2O -4e = PbO2 + 4H0 + SO42-
2PbSO4 + 2H2O = Pb + PbO2 +2H2SO4
Ионы в растворе движутся. При окончании зарядки аккумулятора является «кипение».
«Кипение» — это электролиз серной кислоты.
- К: 2H+ +2e = H2↑
+А: 2H2O -4e = O2↑ -4H+
№46.Водородно-кислородный топливный элемент.
Топливные элементы, это устройство в которых химическая энергия топлива непосредственно превращается в электроэнергию.
Если окислитель и восстановитель хранятся в не элемента и в процессе работы подаются к электродам которые не расходуются, то такой элемент может работать длительное время и называется топливным элементом. В качестве топлива, в топливных элементах используются горючие газы или горючие жидкости. В качестве окислителя используется кислород воздуха. Чаще всего топливный элемент бывает кислородно-водородным. В этом элементе, реакция в котором H2O жидкость. 2H2 (Г) + О2 (Г) = 2Н2О (жидкость)
Водород и кислород подаются во внутрь пористых трубчатых электродов. Водород даётся в электрод А, водород подаётся в электрод В. Пространство В между электродами КОП
- А (Na) 2H2 + 4e +4OH- = 4H2O
+К (CH2) O2 + 2H2O + 4e = 4OH-
2Н2 + О2 = 2Н2О
Максимальная ЭДС такого элемента 1,23 вольта. Основную трудность при конструировании топливных элементов составляет скорость которые могут обеспечить достаточную скорость процесса.
№47.Коррозия металлов. Виды коррозионных разрушений. Химическая коррозия.
Коррозия это химическая или электрохимическая разрушение металлов и сплавов под действием окружающей среды, коррозия происходит обычно самопроизвольно т.к. энергия затраченная на получении метала накапливается в них в виде свободной энергии Гиббса ∆G, При коррозии происходит самопроизвольное разрушение металлов, в результате взаимодействия их с окружающей средой.
Ме0 - m e = Me n- ; ∆G < 0
Корозия приносит большой электролитический ущерб, во первых в результате коррозии понижается механическая прочность металлической конструкций, во II части метал необратимо разрушается (ежегодно теряется до 10% метала от ежегодного выплавляемого).
По характеру коррозионных разрушений различают следующие виды коррозии:
1) Равномерная коррозия.
2) Неравномерная.
Равномерная коррозия — это сплошная коррозия.
Неравномерная коррозия делится на коррозию:
а) точечная коррозия;
б) пятнистая коррозия;
в) язвенная коррозия;
г) межкрестальевидная коррозия;
д) селективная коррозия (избирательная)
ж) растрескивающаяся коррозия (самая опасная)
По механизму протекания коррозионных реакции коррозия делится на два типа:
1) химическую коррозию
2) электрохимическую коррозию
№48.Электрохимическая коррозия. Условия ее возникновения. Атмосферная коррозия стали. Почвенная коррозия. Электрокоррозия.
Почвенная (грунтовая или подземная) коррозия — разрушение металлов при контакте с землей. Можно рассматривать собственно почвенную коррозию и коррозию под воздействием внешних токов (электрокоррозия). Почвенная коррозия широко распространена в условиях эксплуатации подземных металлических и железобетонных сооружений.
Атмосферная коррозия является наиболее распространенным вщцтм коррозии, так как большинство строительных конструкций эксплуатируется в атмосферных условиях. Одной из причин ее возникновения является увлажнение поверхностей строительных конструкций. По толщине пленок влаги на поверхности строительных конструкций атмосферную коррозию можно условно разделить на мокрую, влажную и сухую, по району строительства (агрессивности атмосферы) — на коррозию, протекающую в сельской местности, в промышленных районах, в приморской зоне, в условиях специфических загрязнений атмосферы. В зависимости от условий эксплуатации зданий и сооружений атмосферная корроия может протекать в открытой атмосфере с возможностью попадания на поверхности строительных конструкций осадков или с защитой от них, в условиях ограниченного доступа воздуха в замкнутом воздушном пространстве.
Коррозия под напряжением протекает при одновременном воздействии коррозионной среды и механических напряжений. В зависимости от вида и характера напряжений различают коррозионное растрескивание, вызываемое внешними и внутренними растягивающими напряжениями, и коррозионную усталость при циклических знакопеременных внешних нагрузках.
(ещё вопрос №47 по этой теме)
№49. Методы защиты металлов от коррозии, их классификация. Создание рациональных конструкций. Изменение состава и структуры металла.
Коррозию металлов можно затормозить изменением потенциала металла, пассивированием металла, снижением концентрации окислителя, изоляцией поверхности металла от окислителя, изменением состава металла и др. При разработке методов защиты от коррозии используют указанные способы снижения скорости коррозии, которые меняются в зависимости от характера коррозии и условий ее протекания. Выбор способа определяется его эффективностью, а также экономической целесообразностью. Все методы защиты условно делятся на следующие группы: а) легирование металлов; б) защитные покрытия (металлические, неметаллические); в) электрохимическая защита; г) изменение свойств коррозионной среды; д) рациональное конструирование изделий.
Легирование металлов — эффективный (хотя и дорогой) метод повышения коррозионной стойкости металлов. При легировании в состав сплава вводят компоненты, вызывающие пассивацию металла. В качестве таких компонентов применяют хром, никель, вольфрам и др. Широкое применение нашло легирование для защиты от газовой коррозии. При этом используют сплавы, обладающие жаростойкостью и жаропрочностью.
Жаростойкость — стойкость по отношению к газовой коррозии при высоких температурах. Жаропрочность — свойства конструкционного материала сохранять высокую механическую
прочность при значительном повышении температуры. Жаростойкость обычно обеспечивается легированием металлов и сплавов, например стали хромом, алюминием и кремнием. Эти элементы при высоких температурах окисляются энергичнее, чем железо, и образуют при этом плотные защитные пленки оксидов. Хром и кремний улучшают также жаропрочность сталей.
Сплавы Сг—Al—Fe обладают исключительно высокой жаростойкостью. Эти сплавы используют, в частности, в качестве материала для изготовления спиралей и деталей нагревательных элементов печей сопротивления. Жаростойкость никеля еще больше повышается при добавлении хрома. Сплав 20 % Сг и 80 % Ni устойчив на воздухе до 1150 °С. Этот сплав — один из лучших жаростойких и жаропрочных сплавов.
Рациональное конструирование изделий должно исключать наличие или сокращать число и размеры особо опасных с точки зрения коррозии участков в изделиях или конструкциях (сварных швов, узких щелей, контактов разновидных металлов), а также предусматривать специальную защиту металла этих участков от коррозии.
№50. Защитные покрытия.
Они в свою очередь подразделяются: а) химические – это искусственно создаваемые пленки различного состава - (оксидирование, фосфатирование, азотирование и т.д.)
б) неметаллические (краски, лаки, эмали, покрытия полимерными материалами)
в) металлические – бывают анодные и катодные – в зависимости от природы металла.
Если покрытие осуществляют металлом, имеющим меньшее значение стандартного электродного потенциала, чем покрываемый металл, то покрытие называется анодным (например: оцинкованное железо). При нарушении целостности этого покрытия в присутствии электролита (атмосферная влага, соли, кислоты) образуется гальвано пара, в которой роль анода играет металл с меньшим значением стандартного электродного потенциала (т.е. более активный металл покрытия, в данном случаи цинк). В результате покрытие будет разрушаться, а основной металл (железо) остается защищенным до тех пор, пока не будет разрушен весь защитный слой.
Если же металл покрытия имеет большее значение стандартного электродного потенциала, чем основной металл (т.е. более активный металл покрывают менее активным), то покрытие называют катодным (например: луженое железо). При нарушение целостности покрытия разрушается защищаемый металл (железо), а металл покрытия (в данном случаи олово) остается неизменным.
№51. Электрохимическая защита.
1. Протекторная
2. Катодная
3. Анодная
Этот метод защиты основан на торможении анодных или катодных реакций коррозионного процесса. Электрохимическая зашита осуществляется присоединением к защищаемой конструкции металла с более отрицательным значением электродного потенциала — протектора, а также катодной или анодной поляризацией за счет извне приложенного тока. Наиболее применима электрохимическая защита в коррозионных средах с хорошей ионной электрической проводимостью. Катодная поляризация используется для защиты от коррозии подземных трубопроводов, кабелей. Катодную защиту применяют также к шлюзовым воротам, подводным лодкам, водным резервуарам, морским трубопроводам и оборудованию химических заводов.
Сущность катодной защиты заключается в том, что защищаемое изделие подключается к отрицательному полюсу внешнего источника постоянного тока, поэтому оно становится катодом, а анодом служит вспомогательный, обычно стальной электрод. Вспомогательный электрод (анод) растворяется, на защищаемом сооружении (катоде) выделяется водород. Если вспомогательный анод изготовлен из металла, имеющего более отрицательный потенциал, чем защищаемый металл, то возникает гальванический элемент. При этом отпадает необходимость в наложении тока от внешнего источника. Анод растворя растворяется со скоростью, достаточной для создания в системе необходимого электрического тока.
Подобные вспомогательные электроды называют протекторами. Для их изготовления большей частью используют магний и его сплавы, цинк, алюминий.
Разработана также защита металла от коррозии наложением анодной поляризации. Этот метод применим лишь к металлам и сплавам, способным легко пассивироваться при смещении их потенциала в положительную сторону. Анодную защиту применяют, например, для предотвращения коррозии нержавеющих сталей в серной кислоте.
№52. Воздействие на среду с целью снижения ее коррозионной активности. Ингибиторы коррозии.
Для снижения агрессивности среды уменьшают концентрацию компонентов, опасных в коррозионном отношении. Например, в нейтральных средах коррозия протекает с поглощением кислорода à удаляют кипячением или восстанавливают с помощью восстановителей. Агрессивность среды может уменьшаться также при снижении концентрации ионов Н+, т. е. повышении рН. Для защиты от коррозии широко применяют ингибиторы.
Ингибитором называется вещество, при добавлении которого в среду, где находится металл, значительно уменьшается скорость коррозии металла. Ингибиторы применяют главным образом в системах, работающих с постоянным или мало обновляемым объемом раствора. Большое применение находят замедлители в процессах травления металлов для удаления с поверхности окалины или ржавчины.
По механизму своего действия на процесс электрохимической коррозии ингибиторы целесообразно разделить на анодные, катодные и экранирующие, т. е. изолирующие активную поверхность металла.
По составу различают ингибиторы орган и неорган. По условиям, в которых они применяются, их можно разделить на ингибиторы для растворов и летучие ингибиторы, дающие защитные эффект в условиях атмосферной коррозии. Так как эффективность действия ингибитора сильно зависит от рН сред, то можно разделить ингибиторы также на кислотные, щелочные и нейтральные.
Механизм действия значительного числа ингибиторов заключается в адсорбции ингибитора на корридирующей поверхности и последующем торможении катодных или анодных процессов.
К анодным замедлителям нужно отнести замедлители окисляющего действия: итрит натрия NaNC^, дихромат натрия Na2Cr2O7.
Катодные замедлители уменьшают скорость коррозии за счет снижения интенсивности катодного процесса или сокращения площади катодных участков. К катодным ингибиторам относятся органические вещества, содержащие азот, серу и кислород, например диэтиламин, уротропин, формальдегид, тиокрезол.
Летучие ингибиторы вводятся в, контейнеры, в упаковочные материалы или помещаются в непосредственной близости от рабочего агрегата. Благодаря достаточно высокому давлению паров летучие ингибиторы достигают границы раздела металл — воздух и растворяются в пленке влаги, покрывающей металл. Далее они адсорбируются на поверхности металла. В качестве летучих ингибиторов используются обычно амины с небольшой молекулярной массой, в которые вводятся группы МОз или СО3.
№53. Металлические материалы. Общие физ-мех-хим свойства металлов.
1. Химическая: s, p, d, f, активные и неактивные, благородные и неблагородные, амфотерные и неамфотерные.
2. Физические свойства: плотность (легкие d<5 г/см3 и тяжелые d> г/см3), температура плавления (легкоплавкие t<1000 и тугоплавкие t>1500), по твердости (твердость >5 баллов à твердые, алмаз С – 10 баллов, Fe-4, Cs-0.2, Сr-8.5 баллов).
4.Металлургическая классификация: черные и цветные.
Химические свойства металлов: все металлы проявляют восстановительные свойства т.е. способны терять электроны и окисляться
Me0 – ne = Men+ (ок-е, в-ль)
I. Отношение к воде:
1)растворяются Li-Al
а)щелочные Li,Na,K,Rb,Cs,Fr
2Me + 2H2O = 2MeOH + H2
б)щелочно -земельные Ca,Sr,Ba,Ra
Me + 2H2O = Me(OH)2 + H2
в) Be + H2O = Be(OH)2¯ + H2 поэтому реакция прекращается т.е. Be пассивирующий металл.
г) Mg + 2H2O =(100 C)= Mg(OH)2 + H2
д) 2Al + 6H2O = 2Al(OH)3 + 3H2
II. < H2SO4> разбавленная
а) активные растворяются
Fe + H2SO4 =FeSO4 + H2
б) не активные не растворяются
Cu + H2SO4 не идет!
III. < H2SO4> концентрированная
a) à SO2 – неактивные Me
Me+H2SO4(р)à S – среднеактивные
à H2S – Li-Al
б) не растворяются: Fe, Cr, Al (при конц>90%), благородные (кромеAgPd)
2Fe+5H2SO4 =Fe2(SO4)3 + 3SO2 + 3H2O
IV. HNO3 конц (С>55%) при взаимодействии с металлами обычно восстанавливается до диоксида азота NO2
Cu + 4HNO3 = Cu(NO3)2 + 2NO2+ 2H2O
Zn + 4HNO3 = Zn(NO3)2 + 2NO2+ 2H2O
V. HNO3 разбавленная
à N2 среднеактивные
à NO неактивные
Me+ HNO3à N2O среднеактивные
à NH4NO3 высокоактивные
Me + HNO3 = Me(NO3)n + H2O
VI. водные растворы щелочей
Реагируют Be, Al, Zn, Sn, Pb дающие амфотерные гидрооксиды.
2Al+6H2O+2NaOH=2Na[Al(OH)4]+3H2
Na[Al(OH)4]- тетра гидроксо аллюминат натрия
Схема растворения:
Me+H2O+NaOH=NaX[Me(OH)4]+H2
№54. Получение металлов из руд.
Золото и платина в самородном виде. Минералы и горные породы, содержащие соед металлов и пригодные для получения этих металлов заводским путем, носят название руд. Главнейшие руды содержат оксиды, сульфиды и карбонаты металлов. Металлургические процессы, протекающие при высоких температурах, наз пирометаллургическими. Важн способ получ металлов из руд основан на восстановл их оксидов углем или СО.
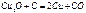
Выплавка чугуна производится восстановлением железных руд оксидом углерода. При переработке сульфидных руд сперва переводят сульфиды в оксиды путем обжига в специальных печах, а затем уже восстанавливают полученные оксиды углем.
Обычно руды представляют собой совокупность минералов. Минералы, содержащие извлекаемый металл, называются рудными минералами, все остальные — пустой породой. Последняя чаще всего состоит из песка, глины, известняка, которые трудно плавятся. Чтобы облегчить выплавку металла, к руде примешивают специальные вещества — флюсы. Флюсы образуют с веществами пустой породы легкоплавкие соединения — шлаки. Во многих рудах количество пустой породы столь велико, что непосредственная выплавка металла из таких руд экономически невыгодна. Такие руды предварительно обогащают — отделяют от них часть пустой породы. В остающемся концентрате содержание
рудного минерала повышается. Существуют различные способы обогащения руд. Чаще других применяются флотационный, гравитационный и магнитный способы.
Флотационный метод основан на различной смачиваемости поверхности минералов водою.
Гравитационное обогащение основано на различии плотности и вследствие этого скорости падения зерен минералов в жидкости.
Магнитный способ основан на разделении минералов по их магнитным свойствам.
Для металлов, не восстанавливаемых ни углем, ни оксидом углерода(II), применяются более сильные восстановители: водород, магний, алюминий, кремний. Восстановление металла из его оксида с помощью другого металла называется металлотермией.
№55. Получение Me высокой чистоты. На протяжении последних десятилетий в связи с развитием новых отраслей техники потребовались металлы, обладающие очень высокой чистотой. Например, для надежной работы ядерного реактора необходимо, Чтобы в расщепляющихся материалах такие «опасные» примеси, как бор, кадмий и другие, содержались в количествах, не превышающих миллионных долей процента. Чистый цирконий — один из лучших конструкционных материалов для атомных реакторов — становится совершенно непригодным для этой цели, если в нем содержится даже незначительная примесь гафния. Перегонка в вакууме. Этот метод основан на различии летучестей очищаемого металла и имеющихся в нем примесей. Исходный металл загружается в спец сосуд, соединенный с вакуум-насосом, после чего нижняя часть сосуда нагревается. В ходе перегонки на холодных частях сосуда осаждаются либо примеси* (если они более летучи, чем основной металл), либо очищенный металл (если примеси менее летучи). Процесс ведется при непрерывной откачке воздуха.
Зонная плавка заключается в медленном протягивании бруска очищаемого металла через кольцевую печь. Тот участок (зона) бруска, кот нах в данный момент в печи, плавится. По мере продвижения бруска жидкая зона перемещается от начала бруска к его концу. Зонной плавке подвергают металл, прошедший предварительную очистку. Содерж примесей в нем уже невелико, так что основной металл и примеси образуют гомогенный твердый раствор. При движении бруска через кольцевую печь происходит пла вление металла у передней границы зоны и кристаллизация его у задней границы. При этом состав образ кристаллов, наход в равновесии с расплавом, отличается от состава.
Карбонильный процесс. Этот метод применяется для получения высокочистых никеля и железа. Подлежащий очистке никель нагревают в атмосфере оксида углерода(II), наход под давлением около 20 МПа. При этом никель взаимодействует с СО, образуя летучий тетракарбонил никеля Ni(CO)4 (темп. кип. 42 °С); содержащиеся в исходном металле примеси в такого рода реакцию не вступают. Образовавшийся Ni(CO)4 отгоняют, а затем нагревают до более высокой температуры. В результате карбонил разруш с выделением высокочистого металла.
Иодидный способ дает возможность получать титан, цирконий значительной чистоты. Исходный металл в виде порошка нагревается до 100—200 °С с небольшим количеством иода в герметическом аппарате. В аппарате натянуты титановые нити, нагреваемые электрическим током до 1300—1500 °С. Титан (но не примеси) образует с иодом летучий иодид TiI4, который разлагается на раскаленных нитях. Выделяющийся чистый титан осаждается на них, а иод образует с исходным металлом н овые порции иодида.
№56. Алюминий. Свойства и применение в технике.
Эл конфигурация атома Al выраж формулой Is22s22p63s23p1. Во всех устойчивых соед степень окисления +3. По своей распространенности алюминий занимает четвертое место (после О, Н и Si) и является самым распространенным в природе металлом. Основная масса алюминия сосредоточена в алюмосиликатах: полевых шпатах, слюдах и др.
Алюминий — серебристо-белый легкий и чрезвычайно пластичный металл, обладающий высокой теплопроводностью и электрической проводимостью. Аl хим активен; с хлором и бромом он реагирует при комнатной температуре, а с иодом — при нагревании или в присутствии воды как катализатора. При 800 °С алюминий взаимодействует с азотом, а при 2000 °С — с углеродом. На воздухе алюминий покрывается очень прочной тончайшей (10~8 м) оксидной пленкой. Вследствие образования защитной пленки алюминий устойчив по отношению к концентрированным азотной и серной кислотам. Эти кислоты на холоду пассивируют AL. При высоких температурах прочность защитной пленки резко снижается. Если механическим воздействием снять оксидную' пленку, алюминий становится крайне реакционноспособным. Он энергично взаимодействует с водой и водными растворами кислот и щелочей, вытесняя водород и образуя катионы или анионы.
Широчайшее применение Al в технике основано на его ценных физ и хим свойствах и большой распространенности в земной коре. Вследствие высокой электрической проводимости (4-10~5 Ом~-1*См~-1) и малой плотности они спользуется для изготовления электрических проводов. Высокая пластичность алюминия позволяет изготовлять из него тончайшую фольгу, которую применяют в конденсаторах и заменяют Al свинец в оболочках кабелей. Из-за ненамагничиваемости сплавы Al применяются в радиотехнике. Основная масса алюминия используется для получения легких сплавов — дуралюмина (94% А1, остальное Си, Mg, Мп, Fe и Si), силумина (85—90% А1, 10—14% Si, остальное Na) и др. Алюминий применяется, кроме того, как легирующая добавка к сплавам для придания им.жаростойкости. Алюминий и его сплавы занимают одно из главных мест как конструкционные материалы в самолетостроении, ракетостроении, машиностроении и т. п. Коррозионная стойкость алюминия (особенно анодированного) значительно превосходит коррозионную стойкость стали. Поэтому его сплавы используются как конструкционные материалы и в судостроении. Al прим в алюминотермии для получения ряда металлов и для сварки термитным методом. Алюминотермия основана на высоком сродстве алюйи-ния к кислороду.
8А1 + 3Fe3O4 = 4А12О3 + 9Fe
№57. Медь. Свойства и применение в технике.
Общее содерж Cu в земной коре сравнительно невелико [0,01% (масс.)], встречается в самородном состоянии. В настоящее время медь добывают из руд: оксидные и сульфидные. Сульфидные руды имеют наибольшее значение, поскольку из них выплавляется 80% всей добываемой меди.
Важнейшими минералами, входящими в состав медных руд, являются: халькозин, или медный блеск, Cu2S, халькопирит, или медный колчедан, CuFeS2; малахит. Месторождения на Урале, в Казахстане и в Закавказье.
Медные руды содержат большое количество пустой породы, так что непосредственное получение из них меди экономически невыгодно. Поэтому в металлургии меди особенно важную роль играет обогащение (обычно флотационный метод), позволяющее использовать руды с небольшим содержанием меди.
Чистая медь — тягучий вязкий металл светло-розового цвета, она очень хорошо проводит теплоту и электрический ток, уступая в этом отношении только серебру. В сухом воздухе медь почти не изменяется, так как образующаяся на ее поверхности тончайшая пленка оксидов (придающая меди более темный цвет) служит хорошей защитой от дальнейшего окисления. Но в присутствии влаги и диоксида углерода поверхность меди покрывается зеленоватым налетом карбоната гидроксомеди (СuОН)2СОз. При нагревании на воздухе в интервале температур 200—375°С медь окисляется до черного оксида меди(II) СuО. Вви Ввиду высокой теплопроводности, электрической проводимости, ковкости, хороших литейных качеств, большого сопротивления медь широко используется в – промышленности.
Большие количества чистой электролитической меди (около 40% всей добываемой меди) идут на изготовление электрических проводов и кабелей. Из меди изготовляют различную промышленную аппаратуру: котлы, перегонные кубы и т. п. Сплавы меди с другими металлами: латуни (сплавы меди с цинком), медноникелевые сплавы и бронзы.
Латуни содержат до 45% цинка. Из них изготовляют трубы для конденсаторов и радиаторов, детали механизмов, в частности часовых. Медноникелевые сплавы: радиаторы, трубопроводы, дистилляционные установки для получения питьевой воды из морской, магазинов сопротивления. Бронзы подразделяются по основному входящему в их состав компоненту (кроме меди) на оловянные, алюминиевые, кремнистые и др.
В хим отношении медь является малоактивным металлом. Однако с галогенами она реагирует уже при комнатной температуре CuCl2. При нагревании медь взаимодействует и с серой Cu2S. Находясь в ряду напряжений после водорода, медь не вытесняет его из кислот. Но
2Сu + 4НС1 + О2 = 2СuС12 + 2Н2О
Соединения меди: CuO, Сu(OH)2, СuSO4(сульфат), СuCl2 (хлорид),
Сu(NO3)2 (нитрат), (CuOH)2CO3 (карбонат гидроксомеди),
Cu(CH3COO)2*H2O (ацетат меди).
№58. Цинк. Свойства и применение в технике.
Цинк Zn и его электронные аналоги — кадмий Сd и ртуть Hg — являются элементами побочной подгруппы второй группы периодической системы элементов. Электронная структура атомов этих элементов может быть выражена формулой... (п — 1) d 10ns2, где п — номер внешнего электронного слоя, совпадающий с номером периода, в котором находится элемент. Валентность цинка и его аналогов постоянна и равна двум, что отвечает возбужденному состоянию атомов: ns2 à nslnpl. Электроны стабилизированного (n— 1) d — энергетического подуровня при возбуждении атомов не распариваются и не влияют на валентные свойства рассматриваемых элементов.
Цинк—белые металлы с синеватым (Zn) оттенком. Во влажном воздухе они покрываются оксидными пленками и теряют свой блеск. Цинк при обычных условиях довольно хрупок.
Цинк — химически активный металл (степень окисления Zn во всех соединениях +2) легко растворяется в кислотах и щелочах:
Zn + 2H+ +4Н20 = Н2 + [Zn(H20)4]2+
Zn + 2ОН-- +2Н20 = Н2 + [Zn (ОН) 4]2-
вытесняя из них водород и образуя соответственно положительно заряженные аквакомплексы или отрицательно заряженные гидроксокомплексы. Координационное число комплексообразователя Zn2+ равно четырем. Скорость взаимодействия цинка с растворами кислот и щелочей зависит от относительной кислотности (щелочности) раствора. Взаимод Zn с HNO3 и конц H2SO4:
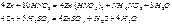
При нагревании цинк: образуются оксиды ZnO. В воде оксиды цинка, кадмия и ртути нерастворимы.
Оксид и гидроксид цинка имеют амфотерный характер и могут растворяться как в кислотах, так и в щелочах.
Соединения Zn2+, Cd2+ и Hg2+ склонны к комплексообразованию. Так, например, образованием комплексных аммиакатов можно объяснить способность гидроксидов цинка и кадмия растворяться в аммиаке:
Zn(OH)2 + 4NH3 = [Zn(NH3)4)2+ + 2ОН-- Cd(OH)2 + 6NH3 = [Cd(NH3)6)2+ + 2OH-
Применение цинка и его аналогов разнообразно. Большая часть цинка используется для оцинкования железа в целях предохранения последнего от коррозии (анодное покрытие), а также для получения различных сплавов (например, латуней, нейзильберов и др.). Цинк применяют в некоторых гальванических элементах.
Соединения цинка и металлов его подгруппы широко применяются в различных областях промышленности. Сульфид и оксид цинка, легированные некоторыми примесями, входят в группу веществ, обладающих способностью люминесцировать — испускать холодное свечение в результате действия на них лучистой энергии или электронов.
Раствор ZnCl2 в НС1 применяют для травления металлов, при пайке для удаления с поверхности металлов оксидов и гидроксидов. Hg2Cl2 — каломель используется для изготовления электродов.
№59. Германий и кремний. Свойства и применение в технике.
Кремний встречается в виде одной устойчивой модификации, так как для кремния характерна лишь полная sр3-гибридизация электронных орбиталей. Алмазоподобная модификация кремния тугоплавка, имеет высокую твердость и напоминает по внешнему виду темно-серый металл. При комнатной температуре кремний является полупроводником. На внешнем электронном слое атома кремния есть вакантные 3d-орбитали (Si...3s23p23d10), что отличает структуру внешнего слоя атома Si от атома углерода (C...2s22p2). Вакантные Зd-орбитали могут участвовать в образовании связей, что сказывается на свойствах образуемых простых веществ: алмазная модификация углерода — изолятор, а алмазоподобная модификация кремния — полупроводник.
Кремний при комнатной температуре химически инертен. Хлором он окисляется лишь при 400 °С, а кислородом — при 600 °С. При 1000°С идет взаимодействие 3Si + 2N2=Si3N4
при 2000 °С Si + C=SiC
Кремний растворяется в щелочах
Si + H2O + 2KOH= K2SiO3 + 2H2
или в смеси плавиковой и азотной кислот
3Si+4HN03+18HF=3H2SiF6+4NO+8H2O
В приведенных реакциях кремний проявляет восстановительные свойства и степень его окисления в продуктах реакции равна +4. При взаимодействии с металлами кремний является окислителем: 2Mg+Si=Mg2Si
Кремний широко применяют в полупроводниковой технике (в виде сплава с железом — ферросилиций) и в металлургии для раскисления сталей и повышения их коррозионной стойкости. Диоксид кремния SiO2 (кремнезем) имеет несколько модификаций, из которых наиболее распространен кварц. Кварц обладает большой твердостью, высокой температурой плавления (1728 °С) и кипения (2950 °С), а также химической стойкостью по отношению ко многим реагентам. Кремнезем легко переходит в стеклообразное состояние. Кварцевое стекло химически и термически весьма стойко. Кварцевое стекло находит широкое применение в химических лабораториях, в производстве агрессивных веществ и т. д. Соединения: кремневая кислоты H2SiO3(правильней выражать формулой nSiO2mH2O), разный состав имеют и соли — силикатыгидрид кремния SiH4— силан.
Германий — полупроводник с довольно большой шириной запрещенной зоны. В ряду стандартных электродных потенциалов Ge расположен после водорода. В связи с этим германий не растворяется в разбавленных НС1 и H2SO4. Усиление металлических свойств в ряду Ge—Sn—Pb сказывается и на их отношении к HNO3:
Ge+4HNO3(конц)=H2GeO3+4NO2+Н2О
Sn+4HNO3(конц)=H2SnO3+4NO2+H20
Pb+4HNO3(ко)=Pb(NO3)2+2NO2+2Н2О
Германий и олово, реагируя с концентрированной HNO3, образуют германиевую и оловянную кислоты. Германий взаимодействует с щелочами только в присутствии окислителей:
Ge +2КОН+О2+2Н2О=К2[Ge+4 (ОН)6]
Германий в основном применяется в полупроводниковой технике.
№60. Олово и свинец. Свойства и приминение в технике.
Олово — полиморфно. В обычных условиях устойчиво белое олово (b-модификация), но при охлаждении до 13,2 °С оно переходит в серое олово (a-модификация). Белое олово — серебристо-белый металл, электрическая проводимость которого в 8 раз выше, чем у ртути. Серое олово — полупроводник с алмазоподобной кристаллической решеткой. Плотность a-Sn невелика (5,85 г/см3) по сравнению с плотностью b-Sn (7,29 г/см3).
Свинец — темно-серый мягкий металл, тяжелый, с невысокой температурой плавления и типичной для металлов электрической проводимостью.
При комнатной температуре Ge и Sn устойчивы по отношению к воде и воздуху. Свинец окисляется кислородом воздуха; на его поверхности образуется синевато-серая оксидная пленка. Поэтому РЬ при контакте с воздухом теряет металлический блеск. При нагревании германий, олово и свинец реагируют со многими неметаллами, образуя соединения, в которых степень окисления Ge и Sn равна +4 (GeO2, SnCl4 и пр.), а РЬ — +2 (РЬО, РЬС12 и т. п.).
В ряду стандартных электродных потенциалов Ge расположен после водорода, а олово и свинец — непосредственно перед водородом. В связи с этим германий не растворяется в разбавленных НС1 и H2SO4. Олово взаимодействует с соляной кислотой, вы- тесняя из нее водород:
Sn + ЗНСl(конц)=НSnС13 + Н2
Sn + 4HCl(конц)=Н2SnC14 + Н2
Усиление металлических свойств в
ряду Ge—Sn—Pb сказывается и на их отношении к азотной кислоте:
Ge+4HNO3(конц)=H2GeO3+4NO2+Н2О
Sn+4HNO3(конц)=H2SnO3+4NO2+H20
Pb+4HNO3(ко)=Pb(NO3)2+2NO2+2Н2О
Германий и олово, реагируя с концентрированной HNO3, образуют германиевую и оловянную кислоты, а свинец — соль. При взаимодействии с разбавленной HNO3 олово переходит в катионную форму:
3Sn+8HNO3(р)=3Sn(NO3)2+2NO+4Н2О
При нагревании олово и свинец растворяются в водных растворах щелочей:
РЬ+2Н2О+2КОН=К2[Pb+2(ОН)4]+Н2
Германий взаимодействует с щелочами только в присутствии окислителей:
Ge+2КОН+О2+2Н2О=К2[Ge+4 (ОН) 6]
Олово — компонент многих сплавов, например подшипниковых (баббиты) типографских (гарт). Но главное направление использования (Шова — лужение железа, получение белой жести, потребителем которой в основном является консервная промышленность.
Свинец, как и олово, — компонент многих легкоплавких сплавов. В больших количествах РЬ используется для изготовления аккумуляторных пластин и оболочек электрических кабелей. Специфично применение свинца для защиты от g-излучения (стенки из свинцовых кирпичей).
№61. Полимерные материалы. Их классификация.
На основе полимеров получают волокна, пленки, лаки, клеи, резины, пластмассы и композиционные материалы (композиты).
Волокна получают путем продавливания растворов или расплавов полимеров через тонкие отверстия (фильеры) в пластине с послед затвердеванием.
Полимерные пленки получ из расплавов полимеров методом продавливания через фильеры с щелевидными отверстиями. Пленки испол в качестве-электроизоляционного и упаков материала, основы магнитных лент.
Лаки — растворы пленкообразующих веществ в органических растворителях. Кроме полимеров лаки содержат вещества, повышающие пластичность (пластификаторы), растворимые красители, отвердители.. Применяются для электроизоляционных покрытий, а также в качестве основы грунтовочного материала и лакокрасочных эмалей.
Клеи- композиции, способ соед различ материалы вследствие образ прочных связей между их поверхностями и клеевой прослойкой. В состав композиции входят отвердители, наполнители, пластификаторы и др.
Пластмассы — это материалы, содержащие полимер, который при формировании изделия находится в вязкотекучем состоянии, а при его эксплуатации — в стеклообразном. Все пластмассы подразделяются на реактопласты и термопласты. К реактопластам относятся материалы на основе фенолофор-мальдегидных, мочевиноформальдегидных, эпоксидных и других смол. Термопласты способны многократно переходить в вязкоте кучее состояние при нагревании и стеклообразное-при охлаждении. К термопластам относятся материалы на основе полиэтилена, политетрафторэтилена, полипропилена, поливинилхлори-да, полистирола, полиамидов и других полимеров.
Композиционные материалы (композиты)- сост из полимерной основы, армированной наполнителем в виде высокопрочных волокон или нитевидных кристаллов. Армирующие волокна и кристаллы могут быть металлическими, полимерными, неорганическими (например, стеклянными, карбидными, нитридными, борными). Композиты на основе полимеров, армированных стекловолокном (стеклопластики), обладают высокой механической прочностью (прочность при разрыве 1300—1700 МПа) и хорошими электроизоляционными свойствами. Композиты на основе полимеров, армированных углеродными волокнами (углепластики), сочетают высокую прочность и вибропрочность с повышенной теплопроводностью и химической стойкостью.
Применение полимеров. В настоящее время широко применяется большое число различных полимеров.
Полиэтилен [—СН2—СН2— ]п — термопласт, получаемый методом радикальной полимеризации при температуре до 320 °С и давлении. Хороший диэлектрик, может эксплуатироваться в пределах температур от —20 до +100°С. Облучением можно повысить теплостойкость полимера. Из полиэтилена изготавливают трубы, электротехнические изделия, детали радиоаппаратуры, изоляционные пленки и оболочки кабелей (высокочастотных, телефонных, силовых).
№62. Методы синтеза высокомолекулярных соединений. Полимеризация и поликонденсация.
Полимеры — высокомолекулярные соединения, которые характеризуются молекулярной массой от нескольких тысяч до многих миллионов. Молекулы полимеров, называемые также макромолекулами, состоят из большого числа повторяющихся звеньев. Вследствие большой молекулярной массы макромолекул полимеры приобретают некоторые специфические свойства. Поэтому они выделены в особую группу химических соединений.
Отдельную группу также составляют олигомеры, которые по значению молекулярной массы занимают промежуточное положение между низкомолекулярными и высокомолекулярными соединениями.
Различают неорганические, органические и элементоорганиче-ские полимеры. Органические полимеры в свою очередь подразделяются на природные и синтетические. В настоящей главе рассматриваются в основном органические синтетические полимеры.
Методы получения полимеров.
Полимеры получают методами полимеризации или поликонденсации.
Смотри также:
63. Основные полимеры, получаемые полимеризацией.
64. Основные полимеры, получаемые поликонденсацией.
№63. Основные полимеры, получаемые полимеризацией.
Полимеризация — это реакция образ полимеров путем последовательного присоед молекул низкомолекулярного вещества(мономера). При полимеризации не образ побочные продукты и Þэлементный состав макромолекул не отлич от состава молекул мономеров. В качестве мономеров используются соединения с кратными связями: CºC, CºN, CºC, CºO, CºN, либо соединения с циклическими группировками, способными раскрываться, например:
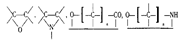
В процессе полимеризации происходит разрыв кратных связей или раскрытие циклов у мономеров и возникновение химических связей между группами с образованием макромолекул, например:
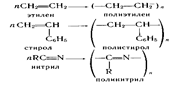
По числу участвующих мономеров различают гомополимеризацию (один вид мономера) и сополимеризацию (два и > мономеров). Полимеризация является цепной реакцией.
При радикальной полимеризации процесс инициируется свободными радикалами. Стадии: а) Инициирование — образование активных центров — радикалов и макрорадикалов. б) Рост цепи происходит за счет присоед к ра дикалам образующихся мономеров с получением новых радикалов.
в) Передача цепи заключ в переносе актив центра на другую молекулу. Радикальная полим-ция служит пром способом синтеза многих полимеров:
поливинил-хлорид [—СН—СНС1—]n, поливинилацетат [-СН2-СН(С2O2Н3)]n,
полистирол [—СН2—СН(С6Н5)—]n, полиакрилат [-СН2-C(CH3((CO2R)—]n, полиэтилен [-СН2-СН2-]n,
полидиены [-СН2-С(R)=CH- CH2— ]n
Ионная полимеризация также проходит через стадию образ активных центров, роста и обрыва цепи. Роль активных центров в этом случае играют анионы и катионы. Соответственно различают анионную и катанную полимеризацию. Методом полимеризации получают 3/4 всего объема выпуск полимеров. Полимеризацию проводят в массе, растворе, эмульсии, суспензии или газовой фазе.
Полимеризация в массе — это полимеризация жидкого мономера в неразбавленном состоянии.
Эмульсионная полимеризация заключается в полимеризации мономера, диспергированного в воде. Для стабилизации эмульсии в среду вводят поверхностно-активные вещества. Способ широко применяется в промышленности для получения каучуков, полистирола, поливинилхлорида, поливинилацетата, полиметилакрила-та.
При суспензионной полимеризации мономер нах в виде капель, диспергированных в воде или другой жидкости.
При газовой полимеризации мономер нах в газовой фазе, а полимерные продукты-в жид или твердом состоянии.
№64. Основные полимеры, получаемые поликонденсацией.
Поликонденсация – это реакция синтеза полимера из соединений, имеющих две или более функц группы, сопровожд образ низкомолекулярных продуктов (Н2О, NH3, НС1, СH2О). Поликонденсация бифункциональных соединений получила название линейной, например
2NH2-(СН2)5-СООН (аминокапроновая кислота) àNH2-(СН2)5-СО-NH-(СН2)5-СООН+Н2О-NH2-(СН2)6-СО-NH-(СН2)5-СООН+NH2-(CH2)5-СООН и т.д. Конечным продуктом будет
капрон [-СО-NH-(СН2)5-]n
Поликонденсация соединений с тремя или более функц группами наз трехмерной. Примером трехмерной поликонденсации служит взаимодействие мочевины и формальдегида.
Так как в процессе поликонденсации наряду с высокомолекулярными образуются низкомолекулярные продукты, то элементные составы полимеров и исходных веществ не совпадают. Этим поликонденсация отличается от полимеризации. Поликонденсация протекает по ступенчатому механизму, при этом промежуточные продукты являются стабильными, т. е. поликонденсация может остановиться на любой стадии. Образующиеся низкомолекулярные продукты реакции (Н2О, NH3, НС1, СH2О) могут взаимодействовать с промежуточными продуктами поликонденсации, вызывая их расщепление (гидролиз, аминолиз, ацидолиз и др.), например
-NH-СО-(СН2)5-NH-СО-(СН2)5— + Н2О à —NH—СО— (СН2)5—NH2—НО—СО— (СН2) 5
Поэтому низкомолекулярные продукты приходится удалять из реакционной среды.
Поликонденсацию проводят либо в расплаве, либо в растворе, либо на межфазной границе.
Поликонденсацию в расплаве ведут без растворителей, нагревая мономеры при температуре на 10—20 °С выше температуры плавления (размягчения) полимеров (обычно 200—400 °С). Процесс начинается в среде инертного газа и заканчивается в вакууме.
При поликонденсации в растворе используют растворитель, который также может служить абсорбентом низкомолекулярного продукта.
Межфазная поликонденсация происходит на границе раздела фаз газ — раствор или двух несмешивающихся жидкостей и обеспечивает получение полимеров с высокой молекулярной массой.
Методом поликонденсации получают примерно четвертую часть выпускаемых полимеров, например
Поликапроамид (капрон),
полигексаметиленадипинамид [—NH(CH2)6NHCO(CH2)4CO— ]п, полиэфиры,
полиуретаны
полисилоксаны [—SiR2—О—] п
полиацетали [—OROCHR'—] п
мочевиноформальдегидные смолы
фенолоформальдегидные смолы
 2015-02-04
2015-02-04 9228
9228