p - связью (перекрыванием) называют связь, образующуюся при перекрывании облаков, имеющих плоскость симметрии, но не имеющих цилиндрической симметрии. В этом случае электронные плотности располагаются вне линии связи с двух ее сторон; таких связей между двумя атомами может быть несколько. Например, если Х - линия связи, то возможно образование двух одинаковых pр-р -связи в результате перекрывания рy-рy и рz-рz (такие связи будут иметь одинаковую энергию, поэтому говорят, что pр-р -связи дважды вырожденны) (рис. 4.11, д).
Существует также редко встречающаяся d-связь, которая образуется при перекрывании d-АО соседних атомов сразу 4-мя лепестками; плохо изучены также химические связи, образующиеся при перекрывании f-орбиталей.
Таким образом, если возвратиться к схеме ВС молекулы СО
(рис. 3.3), то можно сказать, что между атомами существует тройная связь: одна s -связь осуществляется за счет перекрывания 2рх-2рх орбиталей атомов С и О (как на рис. 4.11, г) и две p -связи: одна из них образуется за счет 2рy-2рy перекрывания и лежит в плоскости ХY, а вторая - за счет 2рz-2рz - лежит в плоскости ХZ; две p -связи совершенно одинаковы по перекрыванию, следовательно, и по энергии.
Энергия, кратность и длина связи. Эти характеристики взаимозависимы: чем больше кратность, тем меньше длина и больше энергия связи; при одинаковой кратности - чем меньше длина, тем больше энергия связи.
Ординарная связь образуется одной электронной парой, причем электронная плотность в основном сосредоточена между атомами на оси связи (сигма-связь), рис. 4.11. Вторая связь, образованная второй электронной парой, должна располагаться вне линии связи, так как понятие орбиталь включает в себя и пространство, в котором движется электрон, а благодаря принципу исключения Паули на ней не может быть более 2-х электронов с противоположными спинами. Очевидно, что количество связей между двумя атомами не может быть большим - обычно не более 3-х. Кроме того, можно заключить, что вторая связь слабее первой, так как ее протяженность больше, а электронная плотность — меньше. Однако суммарная энергия кратной связи больше, чем ординарной. Длина же кратной связи уменьшается с увеличением ее кратности.
Пример 1. Какая из молекул прочнее: Сl2, О2?
Решение. Простейший ответ состоит в следующем: валентные электроны атомов хлора и кислорода имеют следующие электронно-графические формулы:
O... 2s2 2p4 Cl.... 3s2 3 р5

Таким образом, в молекуле Cl2 может образоваться одна связь (один неспаренный электрон), получаемая перекрыванием двух р-орбиталей: Px-Px (рис. 3.11, г). У атома кислорода имеется два неспаренных электрона в р-состоянии, т.е. в молекуле О2 могут образоваться две связи (кратность равна двум), одна из них s-типа
(Px-Px), а другая - p (электронная плотность с двух сторон от линии связи х). Следовательно, молекула О2 прочнее (т.к. кратность связи больше) молекулы Cl2.
Следует отметить, что, хотя сделанный выше вывод качественно верен, однако установлено (см. далее метод МО), что: 1) схема ВС правильно даёт кратность связи, но неверно описывает магнитные свойства молекулы О2; 2) в случае Cl2 возможно образование донорно-акцепторных связей за счёт пустых валентных d-АО и несвязывающих электронных пар. За счёт этого кратность связи несколько меньше, а энергия – больше, чем у простой ординарной связи.
Пример 2. Как изменяется прочность связи Н-Э в ряду НF®HCl®HBr®HI?
Решение. Для всех этих молекул схемы ВС одинаковы: имеется одна связь (s-типа - s-px), и нет условий для образования других связей; поэтому та молекула будет прочнее, у которой длина связи будет наименьшей. В указанном ряду атомные радиусы ионов Г- возрастают, что приводит к увеличению длины связей и их ослаблению. Таким образом, при переходе от фтора к йоду прочность связи Н-Э уменьшается (565, 431, 364, 297 кДж/моль, соответственно).
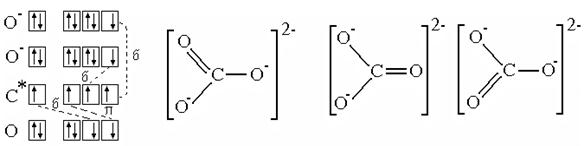
Делокализация связей. Рассмотрим молекулярный ион СО32-. Из экспериментальных исследований известно, что этот ион имеет плоско- треугольное строение - атом С образует связи с тремя атомами О, углы между связями равны и составляют по 1200 каждый; атомы кислорода не связаны между собой (рис. 3.12, б). При построении схемы ВС учтем, что ион имеет два "лишних" электрона, поэтому изобразим его состоящим из атома С (в возбужденном состоянии), атома О и двух ионов О-. Будем рассматривать сначала более сильно перекрывающиеся АО: s s-p- cвязь с атомом О и две s р-р-связи с двумя ионами кислорода (О-). После этого остались еще два неспаренных электрона: один на 2р-орбитали углерода, второй - на 2р-АО кислорода. Эти АО перпендикулярны s- связям иона СО32- и могут образовать pр-р-связь, как на рисунке 3.11, д.
 y 1 y 2 y 3
y 1 y 2 y 3
(а) (б)
Рис. 4.12.СхемаВС (а) и структурные формулы (б) иона СО32-
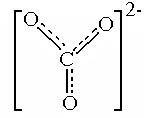
В результате получилась конфигурация, содержащая атом С, имеющий 3s-связи, одну p-связь - с атомом О, содержащая два иона О-. Все связи неравноценны: они должны быть разной длины, не должны быть равны и углы между ними. На самом деле, как доказано экспериментально, все связи, углы и заряды на атомах одинаковы. Для объяснения подобных ситуаций в методе ВС вводитсяпроцедура делокализации, которая состоит в том, что принимаются во внимание другие схемы ВС, подобные схеме (а) на рис 4.12, но с другим порядком расположения атомов и ионов кислорода. Им соответствуют структуры y2 и y3 , и они отличаются от y1 только расположением двойной связи и зарядов на атомах. Волновая функция молекулы получается сложением с равными коэффициентами этих функций:
y = С (y1 + y2 + y3), что соответствует наложению соответствующих конфигураций.
При этом p-связь и заряды на атомах перераспределяются между ними поровну, то есть делокализуются. В результате доля p-связи на каждом из промежутков С-О становится равной  , а заряды на атомах
, а заряды на атомах
 2014-02-02
2014-02-02 1585
1585
