E
Рис. 4.16, а. Схема ВС и структурная формула молекулы XeF4
| E E Е 5s 5p 5d Хе* x x F 2p ½ E ¾ Хе ¾ E ½ E 2s F F F Рис. 4.16, б. Схема ВС и структурная формула молекулы XeF2 |
4. Кратные связи отталкивают сильнее, чем ординарные. Например, молекула ХеО3F2 (тип АВ5, тригональная бипирамида, электронные пары АХ5 + 3π) имеет три атома кислорода в плоскости (углы ОХеО = 120°), так как у них двойные связи, а молекула UO2F5-3 (тип АВ7 - пентагональная бипирамида, электронные пары АХ7 +2π) имеет линейное расположение атомов кислорода, так как углы FUF = 72°, то есть меньше 90°.
5. Искажение углов между связями под действием неподеленной электронной пары тем больше, чем больше число свободных АО на валентной оболочке атома и больше ее размеры. Например, у однотипных молекул NH3, PH3, AsH3 угол в этом ряду уменьшается с увеличением числа валентных АО (табл. 4.3). То же самое можно сказать о молекулах H2O, H2S, H2Se.
Таблица 4.3
Влияние числа валентных АО на валентный угол
| Молекула | NH3 | PH3 | AsH3 |
| Тип валент- ных элект- ронных пар | АХ3Е | АХ3Е | АХ3Е |
| Тип и число ВАО | s + 3p; (4) | s + 3p + 5d; (9) | s+3p+5d+7f; (16) |
| Ð BAB (град.) |
6. В случае тригонально-бипирамидальных молекул аксиальные атомы В ближе к атому А, чем экваториальные; в случае пентагонально- бипирамидальных, наоборот, аксиальные связи короче экваториальных. Это связано с взаимным отталкиванием связывающих электронных пар (Х - Х).
Например, в молекуле PCl5 (тип АВ5 - АХ5 - пентагональная бипирамида) аксиальные атомы имеют длины связей 2,2 А°, а экваториальные - 2,04 А°. Это объясняется меньшим отталкиванием в плоскости, по сравнению с осью молекулы, как в правилах 2 и 4
(рис. 3.17).
Рассмотрим более подробно примеры определения геометрии молекул методом ОЭПВО.
Молекула ХеF4. Для построения схемы ВС берем дважды возбужденный атом Хе: ….5s2p4d2 (рис. 3.16, а). Атомы F образуют 4s - связи с неспаренными электронами Хе*. Все АО этого атома, имеющие электроны, гибридизованы - sp3d2-гибридизация с участием несвязывающих электронных пар. Если бы все шесть гибридных орбиталей были одинаковы, то они образовали бы октаэдр. Однако две из них заняты неподеленными электронными парами (АX4Е2), которые, в соответствии с правилом 2, должны располагаться на одной оси, так что атомы фтора лежат в одной плоскости с атомом Хе и образуют плоский квадрат (табл. 4.4).
Cl       ,2,2 А° ,2,2 А°
 Сейчас читают про:
|
 2014-02-02
2014-02-02 1650
1650









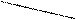
 Cl 2,04 А° Cl
Cl 2,04 А° Cl

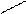

 Cl P
Cl P





