валентной оболочки атома (ОЭПВО)
Метод ВС лежит в основе определения углов между связями и их искажений под влиянием несвязывающих электронных пар. При этом исходят из того, что имеет место отталкивание электронных пар валентной оболочки (ОЭПВО).
Физические основы метода ОЭПВО, предложенного Гиллеспи и Найхолмом, определяются принципом Паули: с учетом того, что атомная орбиталь занимает определенную область пространства, можно утверждать, что в этой области может находиться только одна электронная пара, другие будут выталкиваться из этой области.
Таким образом, главное положение метода ОЭПВО состоит в том, что электронные пары валентной оболочки атома (в молекуле) взаимно отталкиваются и располагаются вокруг атома таким образом (под такими углами), чтобы это отталкивание было минимальным.
Обозначим молекулу (или ее фрагмент) АВn, где А - центральный атом, В - боковой атом (лиганд), n - число атомов В вокруг А. Электронные пары вокруг атома А могут быть связывающими (присоединяют атом В) и несвязывающими или неподеленными (обозначим их Х и Е, соответственно). Тогда электронные пары атома А в молекуле АВn (с учетом несвязывающих пар) можно обозначить как АХnEm. При этомобщее число электронных пар равно n+m. В формуле учитываются только те электронные пары, которые находятся в s - положении к атому А, то есть их электронные плотности направлены по оси связи с атомами В; все Е-пары также находятся в s -положении. В методе ОЭПВО с учётом гибридизации принимают, что все электронные пары занимают примерно одинаковое пространство. Для простоты считают, что они представляют собой сферы одинакового радиуса. Очевидно, что если размеры всех электронных пар вокруг атома А одинаковы, то они образуют правильные фигуры.
Метод ОЭПВО определяет изменения форм молекул и искажения углов между связями по сравнению с идеальными за счет неподеленных электронных пар и кратных связей, а также взаимное расположение неравноценных атомов и электронных пар. Для того чтобы воспользоваться этим методом, нужно прежде всего определить:
1) общее число электронных пар атома А;
2) по этому числу - форму правильной фигуры, образуемой электронными облаками;
3) далее необходимо установить сколько из них связывающих, несвязывающих и кратных. Удобнее всего это можно сделать, воспользовавшись схемой ВС данной молекулы;
4) После этого можно определить геометрию молекулы.
Перечислим основные положения метода ОЭПВО.
1. Несвязывающие электронные пары отталкивают сильнее, чем связывающие, поэтому они искажают форму молекулы. Если, например, по составу электронных пар мы имеем молекулы типа АХ3 (NO3-) и АХ2Е (NO2-), то их форма в соответствии с правилом 1 будет следующей
(рис. 3.15):
В Е
 | |||
 | |||
 Х
Х






 A
A
В В В В
АВ3 (АХ3) АВ2 (АХ2E)
Рис. 4.15.Форма молекул при гибридизации sp2
2. Так как несвязывающие электронные пары отталкиваются сильнее, то при наличии нескольких несвязывающих электронных пар они располагаются на максимальном удалении друг от друга. Например, для молекул типа АВ4 с электронными парами типа АХ4Е2 (ХеF4)
(рис. 3.16, а) будет выгодна плоскоквадратная форма (sp3d2-гибридизация), а для молекул типа АВ2 с электронными парами АХ2Е3 (например, ХеF2) - линейная (рис. 3.16, б).
В последнем случае углы между парами в экваториальной плоскости больше, чем между ней и осью (120 и 900), поэтому взаимное отталкивание Е-Е в плоскости будет меньше.
3. Чем больше электроотрицательность концевых атомов (В), тем сильнее они отталкиваются несвязывающей электронной парой, то есть углы ВАВ меньше. Например, молекулы с электронными парами типа АХ3Е (NH3 и NF3) имеют углы: Ð HNH = 107° и Ð FNF = 102°, что соответствует ЭО (Н) = 2,1 и ЭО (F) = 4.
E E        5s 5p 5d 5s 5p 5d 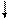 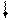 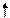 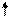           Хе* x x x x Хе* x x x x          E E
2s |
 2014-02-02
2014-02-02 6199
6199






 2p F F
2p F F



 Xe
Xe