Y
кислорода 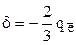 . Валентность (связевая) атома углерода равна 4, а средняя кратность каждой связи С-О равна 1
. Валентность (связевая) атома углерода равна 4, а средняя кратность каждой связи С-О равна 1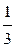 . Длина связи С-О в ионе СО32- равна 0,129 нм и является промежуточной между длиной одинарной (0,143 нм) и двойной (0,122 нм) связей.
. Длина связи С-О в ионе СО32- равна 0,129 нм и является промежуточной между длиной одинарной (0,143 нм) и двойной (0,122 нм) связей.
Пример 3. Объяснить электронное строение молекулы SiF4 методом ВС.
Решение. Электронная конфигурация атома кремния: 1s22s22p63s23p2.
Для присоединения четырех атомов фтора, каждый из которых имеет по одному неспаренному электрону, атом кремния должен иметь четыре неспаренных электрона. У атома кремния в нормальном состоянии имеется неподеленная пара электронов и есть пустые орбитали. Таким образом при возбуждении атома кремния валентные электроны имеют формулу 3s13p3.
3s



 3p 3d
3p 3d
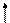
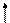
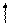
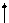



 Si*
Si*
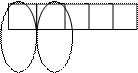
Четыре неспаренных электрона возбужденного атома кремния образуют четыре общие электронные пары с четырьмя атомами фтора (2s22p5), имеющими по одному неспаренному электрону, с образованием молекулы SiF4 (рис. 4.13).
| гибридные АО 3s 3p Si* s s s s 2p 2s F F F F Рис. 4.13.Схема ВС молекулы SiF4 |

Из схемы видно, что атом Si образует 4σ-связи; перечисление АО, образующих эти связи, даёт тип гибридизации АО атома кремния: sp3. Этому соответствуют углы между связями 109028' (тетраэдрический угол).
Пример 4. Объяснить электронное строение иона [SiF6]2- методом ВС. Может ли существовать ион [CF6]2-?
Решение. Для образования иона [SiF6]2- к молекуле SiF4 должны присоединиться два иона фтора (F-), электронная формула которого 1s22s22p6, все электроны спарены. Связь осуществляется по донорно-акцепторному механизму за счет пары электронов каждого из фторид-ионов и двух пустых (вакантных) 3d-орбиталей атома кремния (рис. 3.14). При этом F - донор электронной пары, а атом кремния – акцептор (sp3d2 –гибридизация).
Углерод (1s22s22p2) может образовать, подобно кремнию, соединение СF4, но при этом валентные возможности углерода будут исчерпаны, так как нет неспаренных электронов, неподеленных электронных пар и вакантных орбиталей на валентном уровне.
Таким образом, ион [CF6]2- образоваться не может.
гибридные АО
3s 3p 3d
Рис 4.14. Схема ВС иона [SiF6]2- |
Таким образом, метод ВС имеет следующие преимущества:
1. Соответствие метода химической традиции (молекула состоит из атомов, локализованная связь принадлежит паре атомов).
2. Простота описания сложных молекул с помощью схем ВС и структурных формул.
3. Возможность описания основных типов молекул и взаимодействий, валентности атомов.
Недостатки метода ВС:
1. Громоздкость, неэкономность математического описания.
2. Неверное описание свойств (магнитных, кратности связей, неполное описание геометрии) молекул простыми СВС и необходимость использования в связи с этим искусственных схем.
3. Преувеличение роли локализованных связей.
Недостаток в описании геометрии молекул в значительной степени преодолевается применением относительно простого метода, который приведён далее.
 2014-02-02
2014-02-02 9196
9196







 Si*
Si*



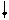
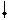
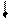
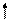
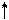
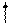



 2p
2p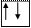
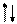
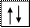
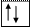
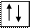
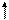

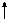

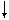
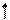






 2s
2s