Понятие о политропных процессах в идеальном газе
Расчёт процессов базируется на первом и втором началах термодинамики, которые мы запишем в дифференциальной форме для одного килограмма термодинамической системы. Пересчёт на всю массу системы будет осуществляться простым умножением удельных характеристик системы на ее массу М.
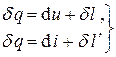 - I начало термодинамики, (3.17)
- I начало термодинамики, (3.17)
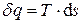 - II начало термодинамики. (3.18)
- II начало термодинамики. (3.18)
Входящие в эти выражения дифференциалы вычисляются следующим образом:
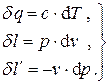 (3.19)
(3.19)
Кроме того, для идеального газа имеем
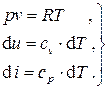 (3.20)
(3.20)
Считается также заданной химическая формула газа или, в случае смеси, её состав, т.е. считаются заданными величины 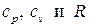 .
.
С математической точки зрения система уравнений (3.17) – (3.20) является незамкнутой, т.к. девять уравнений содержат десять неизвестных. В качестве последнего, десятого, должно задаваться уравнение процесса, т.е. функциональная зависимость между параметрами системы, определяемая наложением внешних условий, связанных со свойствами оболочки, ограничивающей рассматриваемую термодинамическую систему.
На практике чаще всего имеют дело с термодинамическими процессами, в течение которых на каждых малых участках процесса можно с достаточной точностью считать постоянным соотношение между количествами работы и теплоты. Такие процессы называют политропными. Итак, по определению, для политропных процессов имеем:

Поскольку для идеального газа 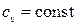 , отсюда следует, что уравнение политропного процесса может быть записано в виде:
, отсюда следует, что уравнение политропного процесса может быть записано в виде:
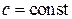 ,
,
т.е. политропный процесс можно определить как процесс с постоянной теплоёмкостью.
Соотношения между параметрами в политропном процессе можно получить на основании уравнений политропного процесса в переменных 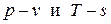 . Используем для этого две записи I начала термодинамики в формах (3.17), подставив в них дифференциалы из (3.19) и (3.20):
. Используем для этого две записи I начала термодинамики в формах (3.17), подставив в них дифференциалы из (3.19) и (3.20):
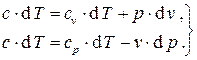 (3.21)
(3.21)
Перенеся слагаемые с 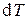 в левые части этих выражений и разделив второе уравнение на первое, получим:
в левые части этих выражений и разделив второе уравнение на первое, получим:
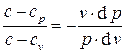 .
.
Комплекс n (постоянный в случае политропного процесса):
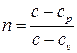 ;
; 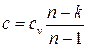 ; (3.22)
; (3.22)
носит название показателя политропы, а с - теплоемкости политропного процесса. Имеем, таким образом:
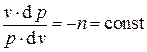 .
.
Разделяя переменные в этом уравнении и интегрируя, получаем связь между давлением и объёмом в политропном процессе в виде:
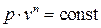 .
.
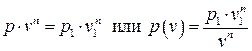 .
.
Далее, получим уравнение политропного процесса в переменных 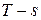 . Из (3.2) и (3.3) имеем:
. Из (3.2) и (3.3) имеем:
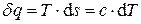 .
.
Отсюда с учётом постоянства теплоёмкости легко получаем:
 .
.
Используя начальные данные 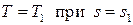 , находим уравнение политропного процесса в координатах
, находим уравнение политропного процесса в координатах 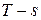 :
:
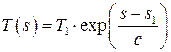 .
.
соотношения между параметрами в политропном процессе:
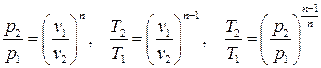
Вычисление количества теплоты в политропном процессе производится в соответствии с определением (1.32) или (1.33), т.е.:
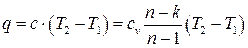 .
.
выражение для удельной работы изменения объёма в трёх эквивалентных формах:
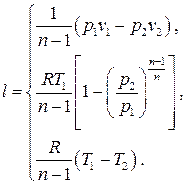
Полезная внешняя работа может быть вычислена
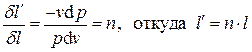
 2014-02-03
2014-02-03 1019
1019








