EX - это подгруппа внеклеточных везикул наноразмеров (30–100 нм) клеточного происхождения, которые недавно были признаны новыми медиаторами многих клеточных процессов и потенциальными биомаркерами для неинвазивной диагностики заболеваний и для мониторинга реакции на лечение, особенно в терапии рака. Все больше доказательств демонстрируют причастность EX к нескольким заболеваниям, включая вирусный патогенез [ 68 ], нейродегенеративные заболевания [ 69 ], а также рост и прогрессирование рака [ 70]. ]. В частности, было обнаружено, что высвобождение EX значительно увеличивается в большинстве неопластических клеток и происходит постоянно на всех стадиях развития опухоли. Растет количество доказательств того, что EX, происходящие из опухоли, несут характерные белки и РНК для различных типов рака, и уровни экспрессии этих молекул тесно коррелируют с прогрессированием опухоли [ 71 ]. Кроме того, экспрессия поверхностных белков может предоставить неоценимую информацию, связанную с физиологическим состоянием родительских клеток, поэтому EX становятся новым инструментом диагностики заболеваний. Хотя EXs имеют несколько белковых маркеров на своей мембране, некоторые из них являются клеточно-специфическими и отражают состояние секретирующей клетки, а это означает, что существует большая гетерогенность среди этих биологических маркеров в единственном образце взятой крови; это затрудняет их изоляцию. На сегодняшний день большинство микрофлюидных устройств все еще несовместимо с клиническим анализом из-за масштабируемости, стандартизации и валидации. Кроме того, несколько подходов отнимают много времени, требуют обширных этапов предварительной обработки и не позволяют получить достаточное количество образцов для геномного или протеомного анализа. Таким образом, 2 ]. Тем не менее, на эффективность обычных методов изоляции в значительной степени влияет загрязнение другими субклеточными структурами, полученными из мембран, с высоким сходством физических свойств, что приводит к очень низким выходам извлечения. К настоящему времени разработаны многочисленные методы выделения EX, включая ультрацентрифугирование, осаждение на основе полимера, фильтрацию и снижение аффинности. В настоящее время наиболее распространенным методом очистки EX является ультрацентрифугирование, которое включает несколько этапов центрифугирования. Осаждение на основе полимеров основано на образовании полимерной сетки, которая запутывает все липидные компоненты в образце и снижает их растворимость для быстрого удаления при низкой центробежной силе [ 72, 73, 74 ]. Мембранная фильтрация также применялась для выделения EX по размеру, но EX склонны прилипать к фильтрующим мембранам, вызывая потерю образца. Более того, дополнительная сила, приложенная для прохождения анализируемой жидкости через мембраны, может потенциально деформировать или повредить EX [ 74 ]. Понижение аффинности лучше при селективном разделении EX с использованием специфических антител, но для этого требуются большие объемы образцов.
|
|
|
|
|
|
В научном сообществе в последнее время распространилась разработка «биодатчиков», способных распознавать EX без этапов очистки из биологических образцов с очень высокой точностью и чувствительностью. Как правило, они сочетают в себе специфичность систем на основе иммуноаффинности с функционализированными наноматериалами. Fang et al. [ 71 ] разработал гибридную платформу, которая объединила два наноматериала с разными поверхностными свойствами: гидрофильный макропористый графеновый пеноматериал (GF) и амфифильный периодический мезопористый кремнезем (PMO). Высокая удельная поверхность GF после модификации антителом против белкового маркера EX, CD63 (специфический маркер экзосом), позволила высокоспецифичное выделение EX из сложных биологических образцов с высокой степенью извлечения. После лизиса метанолом амфифильный PMO использовали для быстрого извлечения белков EX, включая высокогидрофобные мембранные белки. Пептиды, полученные перевариванием белка, анализировали с помощью анализа ЖХ-МС / МС (жидкостная хроматография-тандемная масс-спектрометрия). Zhang et al. сообщили о микрофлюидной платформе на основе системы оксид графена / полидофамин (GO / PDA) [ 75 ]. GO индуцировал самопроизвольную полимеризацию 3D покрытия поверхности PDA, которая, как было продемонстрировано, улучшает эффективность иммунозахвата EX, подавляя эффекты неспецифической адсорбции. Платформа была приготовлена методом послойного покрытия (рис. 2), и захваченные на чипе EX были обнаружены флуоресцентным анализом после обработки смесью биотинилированных антител (CD63, CD81 и EpCAM). Стрептавидин-конъюгированная β-галактозидаза (S β G) использовали в качестве фермента-репортера. Эффективность платформы была подтверждена как при молекулярном профилировании, так и при количественном обнаружении EX в очищенных образцах из линии клеток рака толстой кишки или непосредственно в образцах плазмы пациентов с раком яичников. Спектроскопия поверхностно-усиленного комбинационного рассеяния света (SERS) является многообещающим аналитическим инструментом для сверхдетектирования EX. Биомедицинские приложения SERS включают две общие методологии, называемые безметочным детектированием и косвенные подходы, основанные на использовании рамановского репортера (RaR), связанного с нобелевскими НЧ, обычно известных как SERS-теги или НЧ, помеченные SERS [ 76 ]. Метка SERS состоит из четырех основных компонентов: (1) НЧ серебра или золота, которые действуют как плазмонный усилитель; (2) Рамановский репортер (RaR), действующий как метка отпечатка пальца; (3) защитный слой или оболочка, которая стабилизирует НЧ, позволяя биомолекулам приживаться; (4) узнающие фрагменты. НЧ благородных металлов, индуцирующие повышенное электрическое поле, когда LSPR (локализованный поверхностный плазмонный резонанс) возбуждается выбранными лазерными источниками света [ 16 ] можно рассматривать как ядро тега SERS. RaR, органическое соединение с типичным спектральным отпечатком (например, бензентиол, 4-меркаптобензойная кислота и т. Д.), В идеале должно охватывать НЧ для обеспечения стабильного, интенсивного и надежного рамановского сигнала. Компонент покрытия SERS-tag, хотя и не является существенным, может улучшить стабильность коллоида и обеспечить несколько преимуществ: (а) предотвращение выщелачивания RaR; (б) избегать загрязнения; (c) уменьшить вариации интенсивности из-за взаимодействий NP-NP. Было предложено несколько защитных покрытий, включая биомолекулы (например, бычий сывороточный альбумин), полимеры (например, PEG), неорганическую оболочку (например, SiO 2), липосомы [ 76 ] и графен [ 77]. ]. В последнем случае G действует и как защитная оболочка, и как RaR. Специфические пептиды, антитела или белки прививаются во внешний слой SERS-метки в качестве лигандов узнавания биомаркеров [ 76 ].
|
|
|
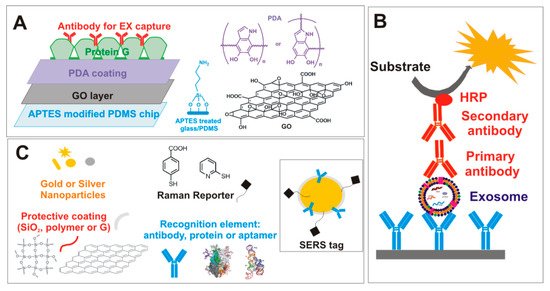
Рисунок 2. (A) Типичная структура микрофлюидной платформы на основе оксида графена / полидофамина (GO / PDA) для иммунного захвата экзосомы. (B) Типичное обнаружение EXs с помощью колориметрического теста ELISA с использованием пероксидазы хрена (HRP) в качестве репортерного фермента во вторичном антителе. (C) Тег поверхностно-усиленного рамановского рассеяния (SERS) со связанным набором инструментов тега SERS.
 2022-01-07
2022-01-07 100
100








