Спектральные и другие оптические методы анализа основаны на ис-пользовании различных явлений и эффектов, возникающих при взаимодей-ствии вещества и электромагнитного излучения (света).
Один из видов спектрального анализа, а именно абсорбционный моле-кулярный анализ (фотометрический) мы рассмотрели в разделе физико – хи-мических методов, так как в ходе выполнения этого анализа используются химические реакции.
В настоящем разделе будут рассматриваться физические метода спек-трального анализа, такие как эмисиионный, атомно - абсорбционный, рентге-новский и масс – спектральный.
| Тема13. Эмиссионный спектральный анализ | ||
| 13.1 Основы метода | ||
| Эмиссионный спектральный анализ основан на определении качествен- | ||
| ного и количественного состава вещества по спектру излучения его атомов. | ||
| При этом измеряется длина волны, интенсивность и другие характеристики | ||
| света, излучаемого атомами и ионами в газообразном состоянии. | ||
| Возбуждение атомов. Атомные спектры. Испускание света атомами | ||
| происходит за счет изменения энергии атомов. В невозбужденном, т.е. нор- | ||
| мальном состоянии атомы обладают минимальной энергией E0. при подведе- | ||
| нии энергии достаточной для возбуждения (например, при столкновении с | ||
| Е, Эв | быстро летящими электронами) | |
| атомы возбуждаются, т.е. пере- | ||
| Еи | ||
| ходят на более высокий энерге- | ||
| Е2 | тический уровень Е1, Е2и т.д. | |
| Е | Через некоторое время (~ | |
| Е3 | 10-8с)атом самопроизвольно воз- | |
| вращается в нормальное или ка- | ||
| Е0 | ||
| кое-то более низкое возбужден- | ||
| Поглощение Излучение | ное состояние. Освобождающая- | |
| Рис.19. Схематическое изображение | ся при этом энергия ∆Е излучает- | |
| поглощения и излучения квантов | ся в виде светового кванта hν: | |
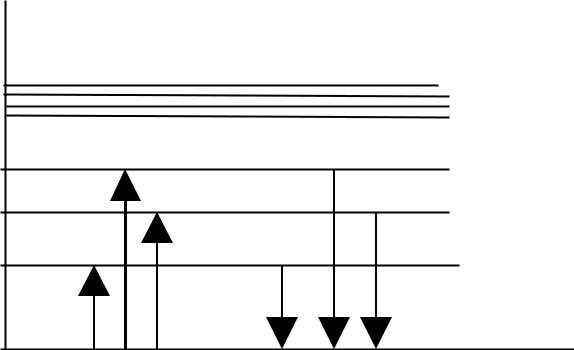
∆Е = Е1 – Е0 = hν,
где h – постоянная Планка; ν – частота излучения.
Выразив частоту излучение (ν) через С – скорость света и длину волны
– λ, получим:
D Е = hl × C

Таким образом, при энергетическом переходе мы получаем излучение определенной длины волны, называемом спектральной линией. Совокупность всех возможных энергетических переходов в атоме составляет его спектр.
Наиболее интенсивной в спектре будет линия, отвечающая переходу с первого возбужденного уровня на основной. Линию, отвечающую этому переходу, называют резонансной.
Каждая спектральная линия имеет определенный потенциал возбужде-ния (Е, эВ). При сообщении атому достаточной высокой энергии происходит отрыв одного или нескольких электронов и превращение его в ион.
Энергия, необходимая для отрыва электрона, называется энергией (по-тенциалом) ионизации (Еu). По величине потенциала ионизации элементы подразделяются на:
-легко ионизируемые (Eu ~ 3,5 – 6 эВ) щелочные и щелочноземельные эле-менты;
-средне ионизируемые (Eu ~ 6 – 9 эВ) большинство металлов; -трудно ионизируемые (Eu > 9 эВ) неметаллы.
Так, самый легко ионизируемый элемент Cs Eu(Cs) = 3,8 эВ; самый труд-но ионизируемый - Не – 24,5 эВ. Необходимую для возбуждения энергию,
атом получает от источников света (пламени, дуги, искры).
Спектр атома любого элемента существенно отличается от спектра его ионов в связи с изменением числа оптических электронов при ионизации. Поэтому в таблицах спектральных линий рядом с символом химического эле-мента приводят римскую цифру, по которой можно судить о кратности иони-зации атома. Цифра I относится к нейтральному атому (например, Fe (I) отно-сится к Fe), цифра II – к однократно ионизованному атому (например, Fe (II) относится к Fe+) и т.д.
 2021-09-15
2021-09-15 93
93








