А. Пируватдегидрогеназа: реакция
В пируватдегидрогеназной реакции участвуют три различных фермента [1-3]. Пируватдегидрогеназа (Е1) катализирует декарбоксилирование пирувата, перенос образованного гидроксиэтильного остатка на тиаминдифосфат (TPP, 1а), а также окисление гидроксиэтильной группы с образованием ацетильного остатка. Этот остаток и полученные восстановительные эквиваленты переносятся на липоамид (1б). Следующий фермент, дигидролипоамидацетилтрансфераза (Е2) переносит ацетильный остаток с липоамида на кофермент А (2), при этом липоамид восстанавливается до дигидролипоамида. Последний снова окисляется до липоамида третьим ферментом, дигидролипоамиддегидрогеназой (Е3) с образованием НАДН + Н+ (NADH + Н+) (3). Электроны переносятся на растворимый НАД+ через ФАД и каталитически активный дисульфидный мостик субъединицы Е3.
Пять разных коферментов этой реакции различными способами ассоциированы с белковыми компонентами ферментов. Тиаминдифосфат нековалентно связан на Е1, Липоамид ковалентно связан с остатком лизина Е2, а ФАД прочно ассоциирован в виде простетической группы на Е3. НАД+ (NAD+) и кофермент А взаимодействуют с комплексом в виде растворимых коферментов.
Пируватдегидрогеназный комплекс (ПДГ-комплекс) бактерии Escherichia coli достаточно подробно исследован. Он имеет молекулярную массу от 5,3 · 106 Да и диаметр больше 30 нм, т. е. ПДГ-комплекс крупнее, чем рибосома. Комплекс состоит из 60 полипептидов (1,2): 24 молекулы Е2 (8 тримеров) образуют ядро комплекса кубической формы. Каждая из 6 граней этого куба занята димерами (возможно, тетрамерами) компонентов Е3, в то время как на 12 ребрах куба лежат димеры молекул Е1. Другие дегидрогеназы кетокислот построены аналогично, но могут отличаться числом субъединиц и молекулярной массой.
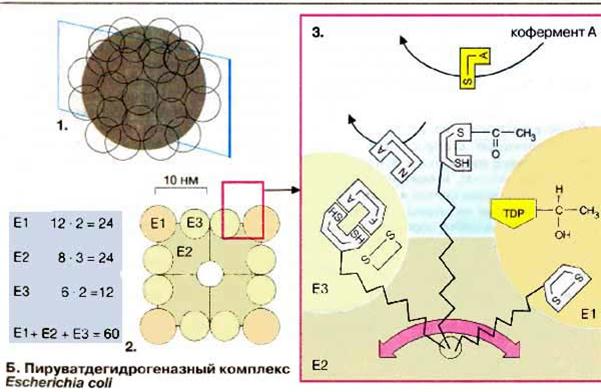
Пространственная организация составных частей комплекса очень важна для катализа. Кофермент, липоевая кислота, очень подвижен благодаря образованию связи с лизиновым остатком фермента Е2. "Ручка" липоамида длиной примерно 1,4 нм в процессе катализа перемещается между E1 и Е3 (3). Липоамид таким способом может взаимодействовать как со связанным в Е1 тиаминдифосфатом, так и с растворимым коферментом А и акцептирующим электроны ФАД в Е3. Белковый домен ацетилтрансферазы, который связывает липоевую кислоту, очень гибок. Это дополнительно повышает дальность действия липоамидной «ручки».
| Заведующий кафедрой биологической химии, д.м.н., проф. | Грицук А. И. | ___________ |
21.10.2006
Министерство здравоохранения Республики Беларусь
УО «Гомельский государственный медицинский университет»
Кафедра биологической химии
Обсуждено на заседании кафедры (МК или ЦУНМС)
Протокол № _________________200__года
ЛЕКЦИЯ
по биологической химии
наименование дисциплины
для студентов _ 2 __ курса лечебного факультета
Тема Ферменты 2. Механизм действия.
Время 90 мин.
Учебные и воспитательные цели:
Дать представление:
1. О механизме действия ферментов. Об этапах ферментативного катализа.
2. О факторах, определяющих активность ферментов [E], [S], [P], Km. О влиянии pH, давления, температуры, ионной силы на активность ферментов.
3. Об изостерической и аллостерической регуляция.
ЛИТЕРАТУРА
1 Березов Т. Т., Коровкин Б. Ф. Биологическая химия. М.: Медицина, 1990. С. 105–123; 1998. С. 143–156.
2 Николаев А. Я. Биологическая химия. М.: Высшая школа, 1989. С. 52–92.
Дополнительная
3 Марри Р. и др. Биохимия человека. М.: Мир, 1993. Т. 1. С. 76–110.
4 Филиппович Ю. Б. Основы биохимии. М.: Высшая школа, 1993. С. 100–111.
5 Ленинджер А. Л. Основы биохимии. М.: Мир, 1985. Т. 1. С. 226–302.
6 Албертс Б. и др. Молекулярная биология клетки. М.: Мир, 1994. Т. 1. С. 113–171.
1. Мультимедийная презентация.
РАСЧЕТ УЧЕБНОГО ВРЕМЕНИ
| № п/п | Перечень учебных вопросов | Количество выделяемого времени в минутах |
| 1. | Механизм действия ферментов. Этапы ферментативного катализа. | |
| 2. | Факторы, определяющие активность ферментов [E], [S], [P], Km. Влияние pH, [P], tº, ионной силы на активность ферментов. | |
| 3. | Изостерическая и аллостерическая регуляция. |
Всего 90 мин
 2014-02-17
2014-02-17 1331
1331
