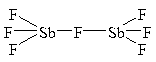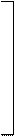Классификация комплексных соединений
Существует несколько способов классификации комплексных соединений, основанных на разных признаках. Наиболее распространённой является классификация по природе лигандов. В зависимости от природы лигандов различают:
аммиакаты (лиганды – молекулы NH3): [Cu(NH3)4]SO4; [Co(NH3)6]Cl3; [Pt(NH3)6]Cl4.
Если роль лигандов выполняют молекулы аминов: этилендиамин – NH2CH2CH2NH2 (обозначаемый как En), метиламин – CH3NH2, этиламин – C2H5NH2 и др. комплексы называют аминатами;
аквакомплексы (лиганды – молекулы Н2О): [Cr(H2O)6]Cl3; [Al(H2O)6]Cl3; [Cu(H2O)4](NO3)2. В кристаллическом состоянии некоторые из аквакомплексов удерживают кристаллизационную воду: [Cu(H2O)4]SO4 ∙ H2O. Кристаллизационная вода не входит в состав внутренней сферы, она связана менее прочно, чем координированная, и легче отщепляется при нагревании;
ацидокомплексы (лиганды – анионы различных кислот). К ним относятся:
– комплексы типа двойных солей: K2[PtCl4], K4[Fe(CN)6], которые можно представить как продукты сочетания двух солей: PtCl2 ∙ 2KCl, Fe(CN)2 ∙ 4KCN;
– комплексные кислоты: H2[SiF6];
– гидроксокомплексы (лиганды – ионы ОН–): Na2[Sn(OH)4], Na2[Sn(OH)6];
переходные ряды комплексов. Включают комплексы с различными по природе лигандами. Запишем переходный ряд между аммиакатами и ацидокомплексами платины (II): [Pt(NH3)4]Cl2; [Pt(NH3)3Cl]Cl; [Pt(NH3)2Cl2]; K[Pt(NH3)Cl3]; K2[PtCl4];
циклические или хелатные комплексные соединения. Содержат би- или полидентатные лиганды, связанные с центральным атомом несколькими связями. Примерами могут служить оксалатный комплекс железа (III) – [Fe(C2O4)3]3– и этилендиаминовый комплекс платины (IV) – [PtEn3]4+:

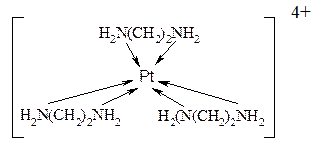
В группу хелатов входят и внутрикомплексные соединения, в которых центральный атом, включаясь в состав цикла, образует ковалентные связи с лигандами разными способами: донорно-акцепторным и за счёт неспаренных атомных электронов. В организме такие комплексы характерны для ионов Cu или Fe с аминокислотами, например, меди с глицином в глицинате меди:
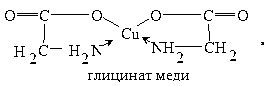 где две связи комплекса донорно-акцепторные, возникающие за счёт донорно-акцепторного взаимодействия неподелённых пар электронов двух аминогрупп кислоты
где две связи комплекса донорно-акцепторные, возникающие за счёт донорно-акцепторного взаимодействия неподелённых пар электронов двух аминогрупп кислоты 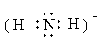 со свободными орбиталями возбуждённого иона меди, две другие – обычные ионные, получаемые замещением в карбоксильных группах ионов Н+ на ионы Cu2+.
со свободными орбиталями возбуждённого иона меди, две другие – обычные ионные, получаемые замещением в карбоксильных группах ионов Н+ на ионы Cu2+.
сэндвичевые комплексы. К ним относятся дибензолхром – Cr(C6H6)2, ферроцен – Fe(C5H5)2 и другие. Это открытая в последнее время группа комплексных соединений с аномально высокой растворяющей способностью, за что они получили название краун-эфиров. Отличаются многоцентровыми, делокализованными связями комплексообразователя с лигандами.
Перечисленные комплексные соединения относятся к одноядерным, содержащим один центральный атом. Помимо них существуют полиядерные, в структуре которых одновременно присутствуют два или несколько центральных атома-комплексообразователя. К полиядерным комплексным соединениям относятся:
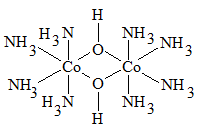
– комплексы с мостиковыми лигандами, где каждые два центральных атома соединены одним, двумя или тремя лигандами одновременно:
| [Sb2F7]– |  
| ||
| [Al2Cl6] |   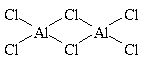 | ||
| [Co2(OH)2(NH3)8]4+ |
|
– кластерные соединения, в которых центральные атомы связаны между собой непосредственно:
| [(CO)5Mn – Mn(CO)5] |   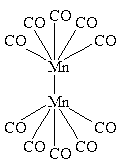 | ||
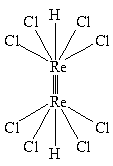
| [Re2H2Cl8]2– | 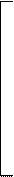 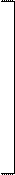
|
|

 В большинстве случаев в кластерных комплексах комплексообразователи объединены помимо прочных одинарных или кратных связей ещё и мостиковыми лигандами:
В большинстве случаев в кластерных комплексах комплексообразователи объединены помимо прочных одинарных или кратных связей ещё и мостиковыми лигандами: | [Ru3O12]12– | 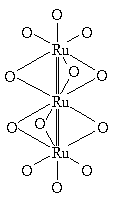 |
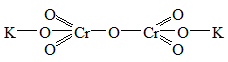
– изополисоединения – полиядерные соединения с комплексными анионами, в которых комплексообразователями выступают атомы одного и того же элемента, а в качестве лигандов (в том числе и мостиковых) – оксид-ионы О2–. Наиболее распространенными из комплексов этого типа являются изополикислоты и их соли: Н4Р2О7, K2Cr2O7 и др., с пространственным расположением атомов:
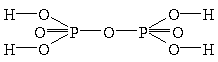
– гетерополисоединения – полиядерные соединения, в комплексных ионах которых содержатся центральные атомы разных элементов, а в качестве лигандов (в том числе и мостиковых) выступают оксид-ионы О2–. К таким соединениям преимущественно относятся гетерополикислоты с общей формулой Н8–n[MnM12VIO40], где n - степень окисления В+3, Si+4, Ge+4, Ti+4, P+5; MVI – Mo или W. Например: Н4[GeMo12O40], H3[PW12O40], H5[BMo12O40].
Названия комплексных соединений составляются по определенным правилам. Согласно рекомендаций IUPAC, вначале указывают состав внутренней координационной сферы. Во внутренней сфере в первую очередь называют анионы, прибавляя к их латинскому названию окончание «о». Например: Cl– - хлоро, CN– – циано, SO32– – сульфито, Н– – гидридо, ОН– – гидроксо и т.д. Далее называют нейтральные молекулы и, прежде всего, молекулы аммиака и его производные. Причём для координированного аммиака используют тривиальный термин – аммин, для воды – аква, для СО – карбонил, для NO – нитрозил. Число лигандов указывают греческими числительными: 1 – моно (часто не приводится), 2 – ди, 3 – три, 4 – тетра, 5 – пента, 6 – гекса.
Затем называют комплексообразователь. Если центральный атом формирует анионный комплекс, то употребляют латинское название элемента, прибавляя к корню окончание «ат», с указанием в скобках степени его окисленности. Если центральный атом входит в состав катиона, используют русское название элемента и в скобках указывают его степень окисленности. В случае неэлектролитов степень окисленности центрального атома не отмечается, так как она вытекает, исходя из электронейтральности комплекса.
После названия внутренней сферы называют внешнюю: кислотные остатки или катионы. Число кислотных остатков, а также катионов определяется валентностью комплексного иона и в названии не отображается. Катионы внешней сферы называются в родительном падеже. Например:
анионные комплексы:
K[Al(OH)4] – тетрагидроксоалюминат (III) калия;
Na4[Fe(CN)6] – гексацианоферрат (II) натрия;
(NH4)2[Pt(OH)2Cl4] – тетрахлородигидроксоплатинат (IV) аммония.
катионные:
[Al(H2O)6]Cl3 – хлорид гексаакваалюминия (III);
[Zn(NH3)4]Cl2 – хлорид тетраамминцинка (II);
[CoCl(NH3)5]Cl2 – хлорид пентаамминхлорокобальта (III).
нейтральные:
[Pt(NH3)2Cl2] – дихлородиамминплатина;
[Cr(H2O)3F3] – трифторотриаквахром;
[Co(NH3)3(NO2)2Cl] – хлородинитритотриамминкобальт.
 2014-02-09
2014-02-09 1563
1563