Под идеальным газом понимают воображаемый газ, в котором отсутствуют силы притяжения между молекулами, а собственный объем молекул исчезающе мал по сравнению с объемом междумолекулярного пространства. Таким образом, молекулы идеального газа принимают за материальные точки. В действительно существующих газах при высоких температурах и малых давлениях можно пренебречь силами притяжения и объемом самих молекул. Поэтому такие газы можно также считать идеальными.
В тех газах, которые находятся в состояниях, достаточно близких к сжижению, нельзя пренебречь силами притяжения между молекулами и объемом последних. Такие газы нельзя отнести к идеальным, и их называют реальными газами.
Идеальные газы строго подчиняются законам Бойля–Мариотта, Гей–Люссака, Авогадро и Дальтона.
Характеристическое уравнение идеального газа или уравнение состояния связывает между собой основные параметры состояния – давление, объем и температуру.
P∙V = M∙R∙T, (1.5)
где р – давление газа, Па, V – объем газа, м3, М – масса газа, кг, Т – температура газа, К, R – газовая постоянная, 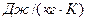 (работа 1 кг идеального газа при постоянном давлении и изменении температуры на 1 К).
(работа 1 кг идеального газа при постоянном давлении и изменении температуры на 1 К).
Уравнение состояния для 1 кг газа
P∙v = R∙T. (1.6)
Если в уравнении (1.5) заменить М на µ, где µ – молярная масса газа, а также учесть, что 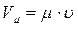 , получим уравнение Клапейрона – Менделеева
, получим уравнение Клапейрона – Менделеева
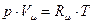 , (1.7)
, (1.7)
где Vµ – объем 1 кмоля рабочего тела, м3/кмоль, Vµ = 22,4 м3/кмоль для всех идеальных газов при нормальных физических условиях (при р = 101325 Па и Т = 273,15 К);
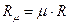 – универсальная газовая постоянная.
– универсальная газовая постоянная.
Удельный объем любого газа при нормальных условиях равен
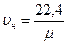 , м3/кг. (1.8)
, м3/кг. (1.8)
Если уравнение (1.7) записать для нормальных физических условий, получим:
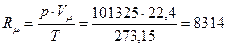 . Дж/(кмоль К).
. Дж/(кмоль К).
Газовая постоянная 1 кг конкретного рабочего тела будет равна:
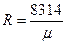 . (1.9)
. (1.9)
Пользуясь характеристическим уравнением для двух различных
состояний какого–либо газа, можно получить выражение для определения любого параметра при переходе от одного состояния к другому, если значения остальных параметров известны:
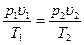 ; (1.10)
; (1.10)
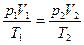 . (1.11)
. (1.11)
Уравнение (1.10) часто применяют для «приведения объема к нормальным условиям» т.е. для определения объема занимаемого газом при р = 101325 Па и Т= 273,15 К, если объем его при каких–либо значениях р и t известен. Для этого случая уравнение (1.10) обычно представляют в виде
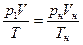 . (1.12)
. (1.12)
 2014-02-09
2014-02-09 4575
4575
