Объединяя выражения первого и второго законов термодинамики, получим основное уравнение термодинамики:
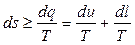 . (3.7)
. (3.7)
Для обратимых процессов оно принимает вид термодинамического тождества:
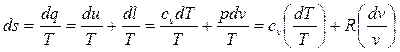 . (3.8)
. (3.8)
После преобразований получим:
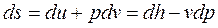 . (3.9)
. (3.9)
Последнее уравнение называют основным уравнением термодинамики, или термодинамическим тождеством.
Интегрируя это тождество и заменяя одну пару параметров состояния с помощью уравнения состояния pv = RT другой, получим формулы для вычисления энтропии для любого состояния газа, отсчитанного от нормального состояния (нормальным состоянием газа при котором энтропия равна нулю – р = 101325 Па, Т = 273,15 К):
при постоянной теплоемкости:
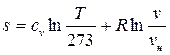 ; (3.10)
; (3.10)
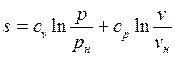 ; (3.11)
; (3.11)
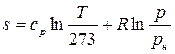 . (3.12)
. (3.12)
Изменение энтропии между двумя произвольными состояниями газа 1 и 2 определяют по следующим формулам:
при постоянной теплоемкости:
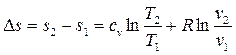 , (3.13)
, (3.13)
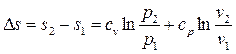 , (3.14)
, (3.14)
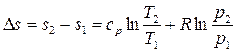 . (3.15)
. (3.15)
При T 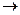 0, s
0, s 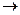 0, однако на практике за нуль отсчета энтропии обычно принимают ее значение S0 в какой–то другой условной точке, например при температуре таяния льда. Тогда ее значения при всех других температурах будут получаться как разность
0, однако на практике за нуль отсчета энтропии обычно принимают ее значение S0 в какой–то другой условной точке, например при температуре таяния льда. Тогда ее значения при всех других температурах будут получаться как разность 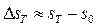 , где
, где 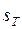 – относительное значение энтропии при заданной температуре Т.
– относительное значение энтропии при заданной температуре Т.
 2014-02-09
2014-02-09 6434
6434
