Количеством теплоты называют меру переданной энергии от одной системы к другой в результате ударов молекул о границу их раздела. направление передачи теплоты называется температурой.
И теплота, и работа, в отличие от внутренней энергии, не являются свойствами системы. Передача теплоты или совершение работы осуществляется лишь при взаимодействии системы с окружающей средой или с другой системой.
Положительной считают теплоту, полученную системой от окружающей среды, и работу, произведенную системой над окружающей средой. Отрицательной считают теплоту, отданную системой окружающей среде и работу, произведенную над системой окружающей средой.
Работа и теплота измеряются в тех же единицах, что и энергия. В системе СИ этой единицей является джоуль (Дж). Существует и другая единица измерения энергии – калория. 1 кал = 4,1840 Дж.
Различие теплоты и работы состоит в том, что теплота – это хаотичное движение молекул, тогда как при совершении работы передача энергии происходит путем упорядоченного (организованного) движения молекул под действием определенной силы).
В 1931 г. Р. Фаулер сформулировал закон транзитивности теплового равновесия, или закон термодинамического равновесия:
если системы А и В находятся каждая в тепловом равновесии с системой С, то можно утверждать, что системы А и В находятся в тепловом равновесии друг с другом.
Это один из основных законов природы.
Пусть две системы А и С до приведения их в контакт друг с другом имели параметры состояния: Р 1 V1 и P2 V2 соответственно. Если привести эти системы в изолированном состоянии в контакт, то установятся новые равновесные давление и объем: Р 1A V1A и P2C V2C соответственно, но эти системы уже не будут независимыми. Теперь они связаны условием равновесия, причем
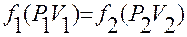
т.е. очевидно, что существует функция, f(P,V) значение которой одинаково для двух систем, находящихся в равновесии друг с другом. такая функция называется эмпирической температурой. Отсюда видно, что определение температуры возможно лишь при условии равновесия.
Нулевой закон термодинамики лежит в основе измерения температуры с помощью термометра.
1-е начало термодинамики
Закон сохранения и превращения энергии известен давно. Достаточно вспомнить сформулированный Ломоносовым закон сохранения массы и энергии.
Опыт показывает, что в макроскопических системах изменение энергии наблюдается в виде теплообмена и виде работы различного рода.
При этом оказывается, что алгебраическая сумма теплоты и работы при различных способах перехода системы из одного состояния в другое сохраняет постоянную величину, а в циклическом процессе она равна нулю.
На основании таких экспериментальных наблюдений в первом законе термодинамики постулируется связь этой суммы с изменением внутренней энергии – функции, зависящей только от состояния системы.
Пусть к закрытой системе подведено количество теплоты Q. Эта теплота идет в общем случае на увеличение внутренней энергии и на совершение системой работы А.
Первое начало термодинамики имеет несколько формулировок и может быть сформулировано так:
1.В любом процессе приращение внутренней энергии системы равно количеству сообщаемой системе теплоты Q минус количество работы А, совершаемой системой:
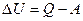
2.Энергия изолированной системы постоянна
Постоянство энергии изолированной системы не исключает возможности перехода одного вида энергии в другой. При таких переходах энергия не теряется и не создается вновь. Отсюда третья формулировка закона:
3.Энергия не исчезает бесследно и не возникает из ничего, переход ее из одного вида в другой происходит в строго эквивалентных количествах.
Внутренняя энергия является функцией состояния, и ее значение не зависит от пути процесса, а зависит только от начального и конечного состояний системы. Но теплота и работа зависят от пути проведения процесса и поэтому функциями состояния не являются. Поэтому, чтобы подчеркнуть это обстоятельство, математическую запись первого закона термодинамики делают так:
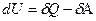
где õА и õQ – 'элементарные теплота и работа.
В уравнении
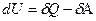
А означает суммарную работу, часть ее представляет собой работу расширения, т.е. ту работу, которую система совершает против сил внешнего давления, она равна pdV и õА" - сумма всех остальных видов элементарных работ (магнитная, электрическая,) т.е. все виды работ, совершение которых не связано с изменением объема системы.
Поэтому первое начало термодинамики в дифференциальной форме часто записывают так:
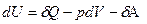
Работу А называют "полезной" работой. В химической термодинамике принимают во внимание только работу расширения, а работу и õА" считают равной 0,поэтому математическая запись первого закона имеет следующий вид:

Отсюда
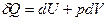
Из этого уравнения следует, что количество теплоты, подведенное к системе или отведенное от нее, идет на изменение внутренней энергии и на работу, совершаемую системой или совершаемую над системой.
Выражения 1-го закона термодинамики для изотермического. изохорного, изобарного и адиабатического процессов. Энтальпия.
При изотермическом процессе передача тепла от одного тела к другому происходит при постоянной температуре.
Если газ идеальный, то внутренняя энергия 1 моля газа не зависит ни от объема, который газ занимает, ни от давления, а зависит только от температуры.
Отсюда при изотермическом процессе, когда U=const, уравнение для 1 закона принимает вид:
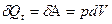
Поэтому после интегрировавания имеем:
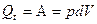
Следовательно, при изотермическом процессе сообщенная системе теплота целиком превращается в работу расширения. А поскольку для 1 моля идеального газа p = RT/V, то для изотермического расширения 1 моля идеального газа получим выражение:
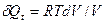 ,
,
после интегрирования получим
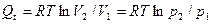 ,
,
При изохорном процессе объем системы постоянен. При dV=0 элементарная работа расширения системы
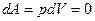 ,
,
при этом уравнение 1-го закона принимает вид:
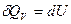
после интегрирования имеем:
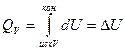
Следовательно при изохорном процессе все количество теплоты, подведенное к системе, идет на изменение ее внутренней энергии.
Последнее уравнение показывает, что QV является функцией состояния.
Для реакций в конденсированной фазе ΔV=0, поэтому
QP=QV
При изобарном процессе P=const,
Тогда уравнение для выражения 1-го закона термодинамики принимает вид:
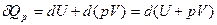
после интегрирования имеем:
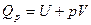
Величина U+pV называется энтальпией.
Энтальпия, это энергия, которой обладает система, находящаяся при постоянном давлении.
Количество теплоты в изобарном процессе является мерой измерения энтальпии. Отсюда видно, что энтальпия является функцией состояния.
Для адиабатического процесса δQ=0, и поэтому
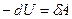
и 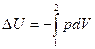 ,
,
т.е. работа производится только за счет изменения внутренней энергии (следовательно, температура системы изменяется)
 2014-02-09
2014-02-09 3064
3064
