ОСНОВНЫЕ ЗАКОНЫ ТЕРМОДИНАМИКИ
| 1. Основные виды процессов. Внутренняя энергия. 2. Теплота и работа. Нулевое начало термодинамики. 3. 1-е начало термодинамики. 4. Выражения 1-го закона термодинамики для изотермического. изохорного, изобарного и адиабатического процессов. Энтальпия. |
Объектом общей термодинамики являются количественные соотношения между теплотой и различными формами энергии, химическая термодинамика отличается тем, что она изучает формы превращения химической энергии в теплоту, механическую работу и другие формы энергии. Объектом химической термодинамики являются тепловые балансы физико-химических процессов, фазовые и химические равновесия. Частью химической термодинамики является термохимия, которая изучает тепловые эффекты химических реакций;
Термодинамика является дедуктивной наукой. (дедукция - логическое умозаключение от общих суждений к частному выводу, в отличие от индукции – логического умозаключения, основанного на обобщении частных случаев или отдельных фактов к одному общему выводу, когда заключение, верное для n случаев, распространяется на n+1 случай).
Она рассматривает различные физико-химические процессы с помощью математического аппарата, т.е. количественно описывает их и опирается при этом на четыре исходных постулата – основные начала (основные законы) термодинамики.
Эти законы можно считать твердо установленными фундаментальными законами природы, поскольку многовековой житейский, производственный и научный опыт человечества показал, что процессы, противоречащие этим законам, никогда не наблюдаются.
Нулевой закон термодинамики – закон транзитивности теплового равновесия, вводит понятие эмпирической температуры и лежит в основе измерения температуры с помощью термометра.
Первое начало термодинамики – представляет собой закон эквивалентности энергии. Оно дает возможность выражать различные виды энергии эквивалентными величинами.
Второе начало термодинамики является законом о направлении процесса и дает возможность предсказать, произойдет ли при данных условиях процесс и в каком направлении.
Третье начало термодинамики – закон об абсолютном значении функции, называемой энтропией. Оно позволяет производить расчеты по химическим равновесиям, не воспроизводя это равновесие экспериментально.
1.Основные виды процессов. Внутренняя энергия..
Отметим основные виды процессов, с которыми в дальнейшем придется иметь дело:
1. изотермический,
2. изобарный,
3. изохорный,
4. адиабатический
5. изобарно-изотермический,
6. изохорно-изотермический,
Кроме того, круговой процесс (цикл) – ряд изменений параметров состояния, заканчивающийся тем, что все они возвращаются к своим первоначальным значениям.
Состояние равновесия – такое состояние системы, при котором ее свойства не изменяются во времени, и в ней отсутствуют потоки вещества или энергии.
Как мы рассматривали выше, если процессы в окружающей среде протекают равновесно, то имеется возможность возвращения рассматриваемой системы из любого промежуточного или конечного состояния в исходное таким образом, чтобы во внешней среде не осталось никаких изменений.
В таком случае процесс называется обратимым.
Равновесные и обратимые процессы могут протекать только бесконечно медленно. Все реальные процессы идут с конечной скоростью и не являются равновесными или обратимыми.
Зачем же вводится такое понятие? Как мы увидим дальше, все расчеты, основанные на законах термодинамики, могут быть найдены именно для равновесных обратимых процессов.
Отметим также и еще одно важное свойство таких процессов: при обратимом процессе, как показал наш пример с расширяющимся газом, работа, совершаемая системой при переходе из начального состояния в конечное, максимальна, а работа, затрачиваемая на обратный перевод системы в начальное состояние, минимальна.
Рассмотрим еще некоторые понятия.
Внутренняя энергия U характеризует общий запас энергии системы. Она включает все виды энергии движения и взаимодействия частиц, содержащихся в системе: ядер, атомов, электронов, молекул, но в нее не входят кинетическая энергия системы в целом и потенциальная энергия в поле внешних сил.
Величина внутренней энергии зависит от природы вещества, его массы и параметров состояния. Абсолютное значение внутренней энергии определить невозможно, так как невозможно перевести систему в состояние, полностью лишенное внутренней энергии. Однако для целей термодинамики это и не требуется: важно определить изменение внутренней энергии, которое определяют как разность внутренней энергии системы ΔU в конечном и начальном состояниях:
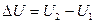
Так как внутренняя энергия является функцией состояния, и ее изменение не зависит от пути процесса, а определяется только начальным и конечным состоянием системы, то dU будет полным дифференциалом:
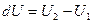
Величина dU считается положительной, если внутренняя энергия системы в рассматриваемом процессе возрастает и отрицательной, если она убывает.
2.Теплота и работа. Нулевое начало термодинамики.
Передача энергии от системы к окружающей среде и наоборот осуществляется в виде работы и теплоты.
Работа, совершаемая системой, обусловлена взаимодействием системы с внешней средой, в результате которого преодолеваются внешние силы, нарушившие равновесие в системе.
Чтобы выяснить сущность теплоты, представим себе сосуд, разделенный на две части теплопроводящей перегородкой. В обеих частях сосуда находится газ, молекулы которого находятся в беспорядочном, хаотичном движении. В левой части температура Т1, а в правой – Т2
При Т1>Т2 молекулы газа левой части сосуда перемещаются с большей скоростью и непрерывно ударяются о перегородку. Теплота, выделяемая при ударах молекул о перегородку, передается молекулам правой части сосуда, которые движутся медленнее и при ударах о перегородку выделяют меньше теплоты. В результате энергия молекул левой части сосуда будет уменьшаться, а правой части – увеличиваться, и температура выравниваться.
 2014-02-09
2014-02-09 1760
1760
