1. Термохимия. Тепловые эффекты. Закон Гесса.
2. Применение закона Гесса для расчета тепловых эффектов химических реакций. Стандартные теплоты образования и сгорания.
3. Теплоемкость
4. Зависимость теплового эффекта реакции от температуры.
Термохимией называют раздел химической термодинамики, исследующий тепловые эффекты химических реакций.
В основе вычисления тепловых эффектов реакций лежит первое начало термодинамики.
Химические реакции обычно протекают при постоянном давлении (например, в открытой колбе) или при постоянном объеме(в автоклаве), т.е. являются изобарным или изохорным процессами.
При химических превращениях освобождается часть содержащейся в веществах энергии. Согласно закону сохранения и превращения энергии, эта часть внутренней энергии системы при химической реакции идет на совершение работы и выделение или поглощение тепла. Работа обычно мала. Ее можно вычислить или ею можно пренебречь.
Теплота реакции имеет значительную величину, и во многих случаях может быть непосредственно измерена, для чего существуют калориметрические методы.
Тепловым эффектом химической реакции называется теплота, выделяемая или поглощаемая в результате химической реакции в необратимом процессе при постоянном объеме или давлении и при условии, что продукты реакции и исходные вещества имеют одинаковую температуру и отсутствуют другие виды работ, кроме расширения.
Значение термохимии на практике очень велико, так как тепловой баланс рассчитывается при многих процессах в технологической практике, медицине и биохимии.
Основой термохимии является закон Гесса, который экспериментально установил русский ученый акад. Г.И. Гесс в 1836-40гг. Этот закон носит также название закона постоянства суммы теплот реакции:
Тепловой эффект химической реакции определяется только природой и состоянием исходных веществ и продуктов, но не зависит от промежуточных химических реакций, т.е. от способа перехода от исходного состояния в конечное.
Закон Гесса является частным случаем закона сохранения энергии.
Для пояснения закона Гесса рассмотрим пример получения водного раствора NH 4Cl из NH3(г) и HCl (г) и воды. Процесс можно провести двумя путями:
1) NH3 (г) + HCl(г) = NH 4Cl(г) (выделяется 41,85 ккал/моль)
2). NH 4Cl(г) + aq = NH 4Cl aq (поглощается 3,92 ккал/моль) (-3,92)
Результат: выделяется 37,93 ккал/моль
2-ой путь:
1). NH3 (г) +aq = NH3 aq выделяется 8,35 ккал/моль (+8,35)
2). HCl(г) +aq = HCl aq выделяется 17,32 ккал/моль (+17,32)
3). HCl aq + NH3 aq = NH 4Cl aq выделяется 12, 27 ккал/моль
Результат: выделяется 37,94 ккал/моль
(Существует два способа записи теплот реакций и соответственно две системы знаков: термодинамическая и термохимическая. В термодинамической теплота считается положительной, если она получена системой. В термохимической положительной – если она выделяется. Поэтому при экзотермических реакциях, когда уменьшается внутренняя энергия системы, энтальпия уменьшается, ΔU и ΔΗ имеет отрицательный знак.
При эндотермических реакциях, когда энергия поглощается системой, наоборот - ΔU и ΔΗ имеют положительные значения.
Термохимические уравнения в связи с этимзаписываются так:
С 6 Н 6 + 7,5 О 2 = 6СО 2 + 3Н 2 О + 780,98 ккал
В термодинамической системе записывают уравнение реакции и рядом указывают величину разности между внутренними энергиями (или энтальпиями) продуктов реакции и исходных веществ:
С 6 Н 6 + 7,5 О 2 = 6СО 2 + 3Н 2 О; Qp = ΔH 0298 –780, 98 ккал
Химические уравнения, в которых указано количество выделившейся или поглощенной теплоты, называются термохимическими уравнениями.
Закон Гесса дает возможность вычислить тепловые эффекты реакции в тех случаях, когда их непосредственное измерение неосуществимо по каким-либо причинам.
Обычно химические реакции проводят или при постоянном объеме, или при постоянном давлении. При этом:
QV =ΔU и Qp = ΔU +pdV =ΔH
из этих уравнений следует, что
Qp - QV = pdV,
т.е. разность тепловых эффектов при постоянном давлении и постоянном объеме равна работе расширения.
Так как pV = nRT, то pΔV = ΔnRT,
где Δn - изменение числа молей газообразных участников реакции.
Дальнейшая подстановка дает уравнение, выражающее соотношение между изобарным и изохорным тепловыми эффектами:
Qp - QV = ΔnRT,
или ΔН = ΔU +ΔnRT
если Δn =0, то ΔН = ΔU
Если в реакции участвуют твердые и жидкие вещества, то при вычислении Δn они во внимание не принимаются. При протекании химических реакций изменение числа молей равно разности стехиометрических коэффициентов в уравнении реакции.
2.Применение закона Гесса для расчета тепловых эффектов химических реакций. Стандартные теплоты образования и сгорания.
Для удобства сопоставления тепловых эффектов вводится понятие о тепловом эффекте реакции при стандартных условиях.
Тепловым эффектом при стандартных условиях (ΔН) называют такой тепловой эффект, который сопровождает реакцию при стандартном давлении (р 0 = 1,013 105 Па) и при стандартной температуре (298 К)
Тепловой эффект при стандартных условиях рассчитывают по стандартным теплотам образования и сгорания.
Стандартной теплотой образования называют тепловой эффект реакции образования 1 моля данного вещества из простых веществ (или элементов) при давлении 1,013 105 Па и при условии, что все участники реакции находятся в устойчивых агрегатных состояниях.
Стандартные теплоты образования обозначаются так: ΔН0 f 298
(formation), определены для примерно 4 тыс. веществ и сведены в таблицы.
Для твердых и жидких веществ стандартным состоянием принимается их устойчивая форма при внешнем давлении 1 атм или 1,013 105 Па. Для газов в качестве стандартного принимается состояние идеального газа при том же давлении 1,013 105 Па.
Стандартные теплоты образования простых веществ (элементов)
(напр. N 2 , O 2, S ромб, C гр ) принимаются равными 0.
Стандартной теплотой сгорания называют теплоту, выделяющуюся при сгорании в атмосфере кислорода 1 моля вещества при стандартном давлении 1,013 105 Па до простейших оксидов. При этом все участники реакции должны быть в устойчивых агрегатных состояниях. Стандартные теплоты образования обозначаются так: ΔН0с298 (combustion).
Стандартные теплоты высших окислов, естественно, приняты равными 0.
Пользуясь табличными данными для ΔН0f298 и ΔН0с298 , можно рассчитать тепловой эффект реакции при стандартных условиях.
При этом применяют следствия из закона Гесса:
1. тепловой эффект реакции при стандартных условиях равен разности между суммой теплот образования продуктов реакции и суммой теплот образования исходных веществ, умноженных на соответствующие стехиометрические коэффициенты:
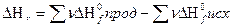
2. тепловой эффект реакции при стандартных условиях равен разности между суммой теплот сгорания исходных веществ и суммой теплот сгорания продуктов реакции, умноженных на соответствующие стехиометрические коэффициенты:
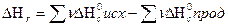
Пример1.
Определите теплоту образования HI (г) по реакции:
½ Н2 + 1/2 I2= HI (г)
Решение. Тепловой эффект здесь равен тепловому эффекту образования HI, так как ΔΗ (Н2 ) и ΔΗ (I2 ) равны 0. По таблицам находим теплоту образования HI, она равна 26,04 кДж/моль.
Пример 2.
Рассчитайте тепловой эффект реакции
СН4 (г) + СО 2 (г)=2СО (г) + 2Н 2
по стандартным теплотам образования.
Решение Из таблиц находят ΔΗ 0 f для участников реакции:
ΔΗ0 f 298 СН4 (г) = -74,85, ΔΗ0 f298 СО 2 (г) = -393,51, ΔΗ0 f298 СО = -110,5, ΔΗ 0fН 2=0
Согласно следствию закона Гесса имеем:
ΔΗ r = 2 ΔΗ0 f298 СО + ΔΗ 0fН 2 - ΔΗ0 f 298 СН4 (г) - ΔΗ0 f298 СО 2 (г) =
2(-110,5,) + 0 – (-74,85 -393,51) = + 247.39 кДж|моль
реакция эндотермическая
по теплотам сгорания:
ΔΗ r = ΔΗ0 f 298 СН4 (г) + ΔΗ0 f298 СО 2 (г) -(2 ΔΗ0 f298 СО + ΔΗ 0fН 2) =
ΔΗ0 с 298 СН4 (г)= -802.32 кДж/моль, ΔΗ0 с298 СО 2 (г) = 0, ΔΗ0 с298 СО= -283,0.
ΔΗ 0сН2= -241.84.
ΔΗ r = -802.32 +0 - (2 -283,0 –2 -241.84) =+247,36 кДж/моль
Закон Гесса имеет исключительно практическое значение. С его помощью можно узнать тепловой эффект любой реакции, не производя для этого непосредственных измерений. Это особенно ценно в тех случаях, когда проведение реакций неосуществимо или искажается побочными эффектами.
Например, (пример3) теплоту образования глюкозы экспериментально найти нельзя, так как реакция, идущая по уравнению:
6С гр +6Н2 (г) +3О2 (г) =С6 Н12 О6 (тв) неосуществима.
Но пользуясь законом Гесса можно скомбинировать термохимические уравнения, из которых можно посчитать этот эффект. Например так:
1. 6С гр +6О2 (г) =6СО2 (г) ΔΗ1= 6 (-94,0) = - 564 ккал|моль
2. 6Н2 (г) +3О2 (г) = 6Н2 О (ж) ΔΗ2 =6 (-68,3) = - 410 ккал/моль
3. С6 Н12 О6 (тв) +6О2 (г) = 6СО2 (г) + 6Н2 О (ж) ΔΗ3= -670 ккал/моль
Аналогичная комбинация энтальпий дает энтальпию образования глюкозы:
ΔΗ1 + ΔΗ2 - ΔΗ3 = ΔΗf C6H12O6
ΔΗf C6H12O6 = - 304 ккал|моль
Здесь теплота образования рассчитана по теплотам сгорания.
Пример 4
Определить теплоту (энтальпию) фазового перехода:
Na (к) = Na (г)
0 108,3
ΔΗ 0возг =108,3 –0 = 108,3 кДж/моль
SO3(ж) = SO3 (г)
-439,0 -396.1
ΔΗ 0исп = -396,1 – (-439) = 42,9 кДж/моль
Пример 5
Определить энергию диссоциации двухатомной молекулы на атомы (энергия химической связи):
Cl2 (г) = 2Сl(г)
0 2(121,3)
ΔΗ0дисс = 2(121,3) -0 =242,6 кДж/моль
Пример6
Определить энергию превращения атома в ион (энергию ионизации):
Н(г) = Н+ (г) + e
217,98 1536,2
ΔΗ0иониз. =1536,2 – 217,98 = 1318, 22кДж/моль
С помощью термохимических расчетов можно определить энергию химических связей, энергию кристаллической решетки, энергию межмолекулярного взаимодействия, энтальпию растворения (гидратации), эффекты фазовых превращений.
ЛЕКЦИЯ 4
1. Теплоемкость.
2. Зависимость теплового эффекта от температуры. Уравнение Кирхгофа.
3. Значение первого начала термодинамики..
Теплоемкостью называется отношение количества сообщенного системе тепла к наблюдаемому при этом повышению температуры (при отсутствии химической реакции, перехода вещества из одного агрегатного состояния в другое и при А" = 0.
Теплоемкость обычно рассчитывают на 1 г массы, тогда ее называют удельной (Дж/г*К), или на 1 моль (Дж/моль*К), тогда ее называют молярной.
Различают среднюю и истинную теплоемкости.
Средней теплоемкостью называют теплоемкость в интервале температур, т. е. отношение тепла, сообщенного телу к приращению его температуры на величину ΔТ
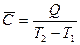
Истинной теплоемкостью тела называют отношение бесконечно малого количества теплоты, полученного телом, к соответствующему приращению его температуры.
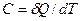
Между средней и истинной теплоемкостью легко установить связь:
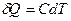 и
и 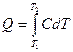
подставив значения Q в выражение для средней теплоемкости, имеем:
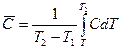
Истинная теплоемкость зависит от природы вещества, температуры и условий, при которых происходит переход тепла к системе.
Так, если система заключена в постоянный объем, т. е. для изохорного процесса имеем:
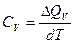
Если же система расширяется или сжимается, а давление остается постоянным, т.е. для изобарного процесса имеем:
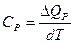
Но õQV = dU а õQP =dH поэтому
CV = (õU/õT)V а
СP = (õH/õT)P
(если одна или несколько переменных поддерживаются постоянными, в то время как другие изменяются, то производные называются частными по отношению к изменяющейся переменной).
Оба соотношения справедливы для любых веществ и любых агрегатных состояний. Чтобы показать связь между СV и СP, надо продифференцировать по температуре выражение для энтальпии Н=U+pV / Для идеального газа
pV =nRT
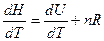
для одного моля
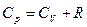 или
или 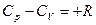
Разность R представляет собой работу изобарного расширения 1 моля идеального газа при повышении температуры на единицу.
У жидкостей и твердых тел вследствие малого изменения объема при нагревании СP = СV
2. Зависимость теплового эффекта от температуры. Уравнение Кирхгофа.
Используя закон Гесса, можно вычислить тепловой эффект реакции при той температуре (обычно это 298К), при которой измерены стандартные теплоты образования или сгорания всех участников реакции.
Но чаще бывает необходимо знать тепловой эффект реакции при различных температурах.
Рассмотрим реакцию:
ν AА+ν BВ= ν CС+ν DD
Обозначим через Н энтальпию участника реакции, отнесенную к 1 молю. Общее изменение энтальпии ΔΗ(Т) реакции выразится равнением:
ΔΗr = (ν C Н С +ν D НD) (ν A Н А+ν B НВ)
Если реакция протекает при постоянном давлении, то изменение энтальпии будет равно тепловому эффекту реакции. И если мы продифференцируем это уравнение по температуре, то получим:
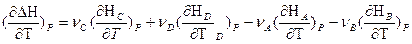
Так как 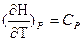
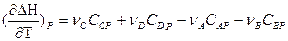
или 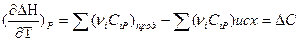
Уравнения для изобарного и изохорного процесса
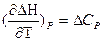 и
и 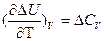
называют уравнениями Кирхгофа (в дифференциальной форме). Они позволяют качественно оценить зависимость теплового эффекта от температуры.
Влияние температуры на тепловой эффект обусловливается знаком величины ΔСp (или ΔСV)
При ΔСp > 0 величина 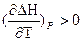 , то есть с увеличением температуры тепловой эффект возрастает,
, то есть с увеличением температуры тепловой эффект возрастает,
при ΔСp < 0 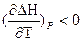 то есть с увеличением температуры тепловой эффект уменьшается.
то есть с увеличением температуры тепловой эффект уменьшается.
при ΔСp = 0 - тепловой эффект реакции не зависит от температуры
То есть, как из этого следует, ΔСp определяет знак перед ΔН.
Для получения расчетной формулы уравнения Кирхгофа интегрируют в пределах интервала температур 298-Т:
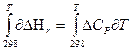
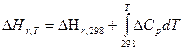
Уравнения эти называются уравнениями Кирхгофа в интегральной форме. По этому уравнению можно рассчитать тепловой эффект только для узкого интервала температур.
При расчете теплового эффекта в большем интервале температур уравнение Кирхгофа интегрируют в пределах 0 –Т К и при этом учитывается зависимость теплоемкости от температуры в виде степенного ряда:
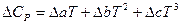
где 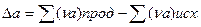
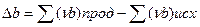
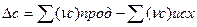
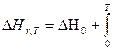
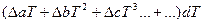
Коэффициенты a,b.c находят экспериментально спектроскопическими или калориметрическими методами. Для многих веществ они приведены в справочных таблицах, ΔН0 -постоянная интегрирования.
4. Значение первого начала термодинамики..
Первый закон термодинамики является универсальным законом природы. Он полностью справедлив и для живых организмов. Протекание процессов в живом организме требует затраты энергии. Она необходима для мышечной деятельности и, в частности, для работы сердца и поддержания постоянной температуры тела. Даже в состоянии покоя человек массой 80 кг отдает окружающей среде 1200 ккал в сутки. Для нормальной жизнедеятельности необходимы потоки веществ из одной части организма в другие. Транспорт этих веществ также требует затраты энергии. В организме совершается и электрическая работа, необходимая для передачи нервных импульсов. Термохимия позволяет составить баланс энергии в живом организме. (Опыты Лавуазье, Лапласа –1780г., на морских свинках – измеряя количество СО 2 и тепла, выделяемого ею, показали, что окисление в организме и прямое сжигание питательных веществ дают близкие тепловые эффекты. Позже У. Этуотер, 1904г. показал на опыте с человеком в калориметре его энергетический суточный баланс).
Наличие энергетического баланса для живого организма показывает, что организм не является источником новой энергии, а подчиняется первому началу термодинамики.
Для изучения тепловых эффектов процессов денатурации белков, взаимодействия их с ионами металлов и ионами гидроксония в организме в последнее время успешно применяется микрокалориметрия. Поскольку тепловые эффекты этих процессов очень малы, (так, теплота денатурации ДНК (переход спираль-клубок) составляет всего лишь 4 ккал на моль), и концентрация этого биополимера в исследуемом объеме очень мала, тепловой эффект измерить возможно только на сверхчувствительном микрокалориметре. Такие приборы - дифференциальные сканирующие микрокалориметры - были сконструированы нашими учеными в академгородке Пущино, под руководством академика Привалова.
 2014-02-09
2014-02-09 17748
17748








