Таким образом, растворы разных по своей природе веществ, но с одинаковой моляльной концентрацией будут кипеть и замерзать при одной и той же температуре.
Следует обратить внимание на важное отличие раствора от чистого растворителя. Если последний кипит и замерзает при постоянной температуре, то растворы делают это в интервале температур, т.е. в процессе их выкипания температура все время повышается, а при замерзании – уменьшается. Это связано с тем, что удаление из жидкой фазы растворителя в виде пара или твердых кристаллов приводит к увеличению моляльной концентрации раствора, т.к. растворенное вещество в процессе кипения и замерзания в неизменном количестве остается в жидкой фазе (вплоть до ее полного выкипания или замерзания), а масса жидкого растворителя уменьшается.
При практических измерениях температуры замерзания или кипения раствора фиксируют момент появления в нем первых твердых кристаллов (для tзам.) или пузырьков газа (для tкип.).
Свойство растворов понижать температуру замерзания позволяет использовать их в роли хладоносителей.
Так, растворы некоторых органических и неорганических веществ используют в качестве антифризов для охлаждения двигателей внутреннего сгорания при работе их в самых разных климатических условиях.
Понижение температуры замерзания растворов имеет большое значение для живых организмов. Так, жидкость в их клетках представляет собой раствор различных неорганических и органических веществ. Его температура замерзания лежит ниже 0оС (273,16 K), поэтому клетки не погибают в условиях переохлаждения.
Благодаря данному явлению растения сохраняются в зимний период. Причем, чем выше концентрация веществ в клеточной жидкости, тем более низкие внешние температуры может переносить растение.
При этом для понижения температуры замерзания раствора в охлаждаемых клетках усиливается процесс гидролиза более высокомолекулярных соединений до низкомолекулярных (например, углеводов – до глюкозы).
Определение понижения температуры замерзания или кипения раствора позволяет решать целый ряд вопросов, касающихся свойств данного раствора и растворенного вещества. Метод исследования, основанный на измерении температуры замерзания растворов, называется криоскопическим методом или криоскопией, а метод, основанный на измерении температуры кипения растворов получил название эбуллископического метода или эбуллиоскопии (рис. 28).
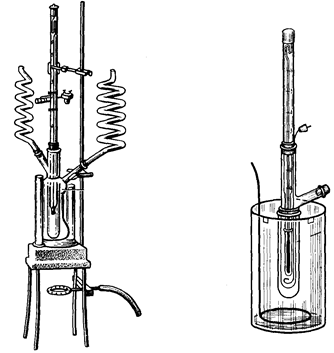
а б
Рис. 28. Аппараты для эбуллиоскопического (а) и криоскопического (б) определения молекулярных масс
В лабораторной практике криоскопический метод нашел значительно большее распространение по сравнению с методом эбуллиоскопии, т.к. измерять температуры замерзания растворов значительно проще и безопаснее чем температуры их кипения.
Так криоскопический метод часто используется для определения молекулярной массы вещества. Согласно следствию из закона Рауля
Dtзам. = K · m = 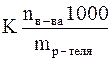
где nв-ва – химическое количество растворенного вещества;
mр-теля – масса растворителя (в граммах).
Учитывая, что 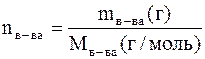 и подставив это выражение в вышестоящее уравнение можно решить его относительно Мв-ва
и подставив это выражение в вышестоящее уравнение можно решить его относительно Мв-ва
Мв-ва = K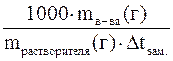
Измерение осмотического давления раствора с помощью осмометра часто бывает не совсем точным, т.к. на практике трудно подобрать подходящую мембрану, которая обладала бы идеальной полупроницаемостью. В этом случае более правильное значение росм. можно получить косвенным путем, например, с помощью метода криометрии.
Измерив Dtзам. раствора, можно рассчитать его моляльную концентрацию 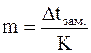 .
.
Для разбавленных растворов (плотность которых близка к плотности воды) без большой погрешности можно принять, что их молярная концентрация С, выраженная в моль/дм3, равна моляльной концентрации m выраженной в моль/кг. Тогда в уравнение Вант-Гоффа для осмоса вместо С можно подставить m (моляльную концентрацию)
росм. = 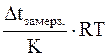
и рассчитать значение осмотического давления раствора.
С помощью метода криометрии можно определять суммарную моляльную концентрацию всех веществ, содержащихся в биологических жидкостях
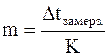 ,
,
а также степень диссоциации слабых электролитов и изотонический коэффициент Вант-Гоффа.
 2014-02-18
2014-02-18 6958
6958








