Различают следующие типы связей атомов в кристаллических решетках.
Кристаллическое состояние вещества. Типы связей атомов в кристаллических решетках
ФИЗИЧЕСКИЕ СВОЙСТВА ТВЕРДЫХ ТЕЛ
Твердыми телами называются тела, отличающиеся постоянством формы и объема. Твердые тела подразделяются на кристаллические и аморфные. Аморфные тела – это переохлажденные жидкости (стекло, вар и т. п.)
Кристаллы - твердые тела, имеющие правильное периодическое расположение составляющих их частиц. Характерным для кристаллов является наличие «каркаса» (решетки), в котором расположены образующие его частицы.
Монокристаллы имеют форму правильных многогранников, обусловленную их химическим составом.
Большинство твердых тел являются поликристаллами и обладают мелкокристаллической структурой, т. е. состоят из большого числа сросшихся мелких, хаотически расположенных кристаллов (кристаллических зерен, кристаллитов).
- Металлическая связь
При переходе металлов в твердое или жидкое состояние, например, при конденсации пара металла, внешние (валентные) электроны атомов утрачивают связь со «своими» атомами и легко переходят от одного атома к другому. Поэтому их называют свободными, или коллективизированными. В узлах кристаллической решетки металлов находятся положительные ионы, получившиеся из атомов после отделения от них электронов, а внутри решетки перемещаются свободные электроны, образующие в металле своеобразный электронный газ.
- Ионная связь
В узлах ионной решетки расположены правильно чередующиеся положительные и отрицательные ионы.. На рис. 21.1 изображена кристаллическая решетка каменной соли (NaCl).
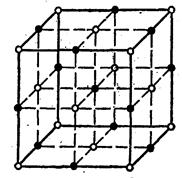
Рис. 21.1
- Атомная (ковалентная) связь
В узлах атомной решетки расположены нейтральные атомы. В такой решетке между атомами существует обменное взаимодействие. Объяснение этого взаимодействия стало возможным только на основе квантовой механики. Примеры: алмаз и карборунд, отличаются своей твердостью и плохой раскалываемостью.
- Молекулярная связь
Эта связь обусловлена межмолекулярными силами взаимодействия (силами Ван-дер-Ваальса) и образует молекулярные кристаллы, к которым относятся большинство твердых органических соединений, сухой лед, йод, парафин.
В узлах кристаллической решетки таких твердых тел расположены нейтральные молекулы.
Межмолекулярные силы обусловлены взаимодействием молекулярных электрических диполей (диполь - дипольным взаимодействием). Диполь - два одинаковых разноименных точечных заряда, отстоящих друг от друга на расстояние, которое называется плечом диполя. Среди возбужденных состояний двух сближающихся молекул имеются такие, которые приводят к дипольному электрическому притяжению и дипольному электрическому отталкиванию. Первые состояния обладают меньшей энергией и должны осуществляться чаще, чем состояния, соответствующие отталкиванию. Результирующий эффект поэтому обязательно приводит к притяжению молекул.
 2014-02-18
2014-02-18 721
721








