Коррозия - это процесс химического или электрохимического взаимодействия материала с окружающей средой, сопровождающийся образованием продуктов коррозии. Последние, в отличие от используемых в судостроении металлических материалов с ценным комплексом механических свойств (прочности, пластичности и др.), зачастую находятся в порошкообразном или рыхлом состоянии, хрупки и имеют практически нулевую прочность. Это неизбежно приводит к снижению конструкционной прочности корпуса судна, деталей СТС и их отказу.
По характеру взаимодействия с окружающей средой различают химическую (протекает в среде, не проводящей электрический ток) и электрохимическую (в среде, проводящей электрический ток) коррозию.
Рассмотрим эти процессы применительно к стали - этот материал является в настоящее время и останется в обозримом будущем основным в судостроении.
В общем случае механизм химической коррозии корпуса судна в морской среде можно как процесс образования оксидной пленки с характерным оранжевым цветом (ржавчины) на поверхности материала в результате взаимодействия железа с кислородом воздуха и водой:
4Fe + 302+2H20 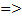 2Fe2
2Fe2 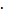 H20 (2.17)
H20 (2.17)
Эта пленка пористая и рыхлая, не образует защитного барьера и не препятствует дальнейшему протеканию коррозии - как химической, так и электрохимической.
Процесс электрохимической коррозии можно разделить на 2 реакции - анодную и катодную. Сталь является структурно неоднородным материалом и состоит из 2-х фаз: феррита (практически чистого железа) и цементита (химического соединения Fe3C). Будучи электроотрицательным (см. выше), железо при наличии электролита - морской воды - является активным участником процесса:
• анодная реакция Fe -> Fe2+ + 2e_
• катодная реакция О2 + 2H2O + 4е~ —> 40Н_
Продукты указанных реакций вступают во взаимодействие друг с другом, образуя вначале гидрооксид железа, который в дальнейшем окисляется и превращается в ржавчину:
Fe2+ + 20Н_ 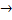 Fe(OH)2
Fe(OH)2 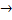 Fe2
Fe2 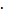 Н20
Н20
Скорость коррозии П (как химической, так и электрохимической) сильно зависит от температуры и может быть выражена известным уравнением Аррениуса:
где П0 - экспериментальный коэффициент, Еакт - энергия активации реакции взаимодействия, температура Т, К.
Если учесть, что температура поверхности забортной воды колеблется в пределах -2... + 35°С и уменьшается с увеличением широты нахождения судна, то теоретически скорость коррозии его корпуса в тропиках в ~ 8 раз больше, чем в Арктике.
Повышение температуры способствует также росту биологических отложений на корпусе судна, особенно его подводной части. Наряду с продуктами коррозии, это увеличивает шероховатость поверхности корпуса и потери на преодоление сопротивления воды движению судна.
Особо интенсивно протекает коррозия в районе переменной ватерлинии – она обычно составляет 0,4 мм/год, а в тропиках может возрастать до 0,9 мм/год. Эти показатели соответственно в 2 и 4,5 раза превышают среднюю скорость коррозии корпуса судна.
Следует отметить, что помимо корпуса судна, коррозии подвержены многочисленные элементы СТС: высокотемпературной химической - головка поршня, крышка рабочего цилиндра и клапаны механизма газораспределения СДВС, электрохимической и химической - внутренние поверхности трубопроводов и насосов системы пожаротушения забортной водой и т.д.
В этой связи знание механизма коррозии и ее основных закономерностей позволяет выработать комплекс мер как при конструировании и изготовлении судна, так и во время эксплуатации, что позволяет в значительной мере снизить интенсивность коррозионного разрушения и вероятность отказов СТС. К ним относятся выбор материалов, соответствующих условиям эксплуатации, покраска поверхностей корпуса судна и СТС, установка протекторов и др. (см. ниже).
 2014-02-09
2014-02-09 908
908








