В координатах p – V (см. рис. 1) работа расширения выражается площадью под кривой давления. Было бы удобно найти систему координат, в которой в виде площади выражалось бы тепло. Фактором интенсивности тепла, по аналогии с фактором интенсивности работы - давлением, может служить температура. В этом случае по оси абсцисс должна быть отложена неизвестная пока функция, обозначаемая S и называемая «энтропией». Этот термин был введен Р. Клаузиусом в 1865г.
Клаузиус назвал отношение δQ/Т энтропией и обозначил через dS.
Так как dS = δ Q /T [Дж/К] есть полный дифференциал, то энтропия не зависит от пути процесса и, так же как и энтальпия, является параметром состояния.
Найдём функцию S. По определению, также как δl= pdv можно написать δq=Tds.
Аналитически значение энтропии для заданного состояния определяется интегрированием уравнения:
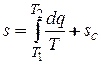 ,
,
 |  |
| Рис. 2 | Рис. 3 |
где sC — константа интегрирования.
Здесь s = S / т - удельная энтропия, отнесённая к единице массы ds = δq/T, [Дж/кг·К].
Тогда первый закон термодинамики напишется в виде
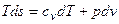 .
.
Из выражения первого закона термодинамики имеем:
δq = du + р · dv = cv • dT + p • dv.
Для интегрирования этого выражения разделим каждый его член на
интегрирующий делитель (Т):
δq/Т = cv • dT/Т + p • dv/Т = cм • dT/Т + R • dv/υ
так как p=R·T/υ.
Таким образом, на основании уравнений первого закона термодинамики и состояния, поделив все члены уравнения первой формы первого закона термодинамики на Т, получим
ds = δq/Т = сv ·dT/T + R · dυ/υ (15)
и, проинтегрировав, получим
s2 – s1 = 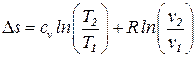 . (16)
. (16)
Удельная энтропия может быть определена как функция основных параметров состояния:
s = f1(р, v);s = f2 (р, Т); s = f3 (T, v).
Учитывая, что dT / Т = dv/ v + dp/ р, после замены в выражении (15)
последовательно dT/T и dv/v, получим выражения энтропии в зависимости от разных пар параметров:
ds = cp· dT/Т - R·dp/p, то есть
s 2- s 1, = срlnT2/Т1 –R· lnp2/p1 (17)
d s = cp· dυ/υ + cv· ln dp/p, то есть
s2 – s1 = cp · In υ2/υ1 + cv • In p2/p1 (18)
Энтропия обозначается для 1 кг газа через s и измеряется в Дж/(кг∙К). Для произвольного количества газа энтропия, равна S=Мs и измеряется в Дж/К.
Формула справедлива как для идеальных газов, так и для реальных тел.
Подобно любой другой функции состояния энтропия может быть представлена в виде функции любых двух параметров состояния:
S=F(Р,V); S=F(Р,T); S=F(V,T).
При температурах, близких к абсолютному нулю, все известные вещества находятся в конденсированном состоянии. В. Нернст (1906г.) экспериментально установил, а М. Планк (1912 г.) окончательно сформулировал следующий принцип: при температуре, стремящейся к абсолютному нулю, энтропия вещества, находящегося в конденсированном состоянии с упорядоченной кристаллической структурой, стремится к нулю,
т.е. Sо= 0 при T = 0 К. Этот закон называют третьим законом термодинамики или тепловой теоремой Нернста. Он позволяет рассчитать абсолютное значение энтропии в отличие от внутренней энергии и энтальпии.
Энтропия применяется для расчёта неравновесных процессов, к которым относятся все процессы в реальных машинах. Это процессы, сопровождающиеся трением поршня или вихреобразованием в газе, или теплоотдачей в стенки. Неравновесность всегда приводит к росту энтропии, т.е. энтропия является мерой потерь или неравновесности. Поскольку в выражении энтропии температура находится в знаменателе, а потери сопровождаются снижением температуры, то в реальных неравновесных процессах энтропия увеличивается.
3.7. Тепловая T-S диаграмма
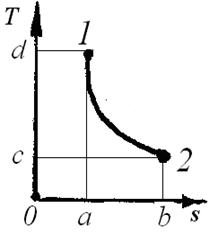
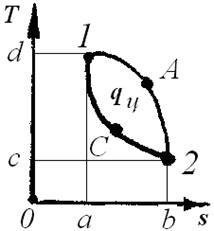
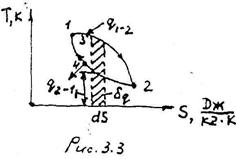 С помощью удельной энтропии и любого другого параметра (например, температуры), удобно изображать графически процессы изменения состояния системы (рис.3.3).
С помощью удельной энтропии и любого другого параметра (например, температуры), удобно изображать графически процессы изменения состояния системы (рис.3.3).
Удельная теплота процесса δq = Т • dS
изображается как элементарная площадка
высотой Т и основанием dS. Разность между подведённым теплом q1-2 и отведённым q2-1 представляет собой теплоту, превращенную в полезную работу (площадь 1-3-2-4-1).
Контрольные вопросы:
1. Газовый процесс
2. Внутренняя энергия идеального газа.
4. Массовая, объемная и мольная теплоемкости.
5. Истинная и средняя теплоемкость.
6. Теплоемкость при постоянном объеме и постоянном давлении.
7. Уравнение Майера.
8. Закон Дальтона.
10. Определение массовой, объемной и мольной долей.
11. Переход от массовых долей к объемным.
12. Переход от объемных долей к массовым.
13. Определение газовой постоянной смеси.
14. Определение парциального давления по массовым и объемным долям.
15. Определение средней молекулярной массы смеси.
16. Массовая, объемная и мольная теплоемкость смеси газов.
17.Работа произвольного процесса.
18.Первый закон термодинамики.
19.Аналитическое выражение первого закона термодинамики.
20.Формулировка первого закона термодинамики через энтальпию.
21.Энтальпия и ее физический смысл.
22. Энтропия и ее физический смысл.
 2014-02-09
2014-02-09 1760
1760







