Лекция 2
ПДК выбрососв АЭС 0,05 Зв/год для персонала0,005Зв/год для населения вблизи
Термодинамическая система может произвести полезную работу только при условии, если в ней осуществляется термодинамический процесс. В этом случае изменяются и основные термодинамические параметры Р, v и Т. Термодинамический процесс - это совокупность изменений состояний термодинамической системы при её переходе из одного состояния в другое.
Мы будем рассматривать только равновесные термодинамические процессы, протекающие в равновесных системах. Равновесным состоянием системы называется состояние, когда во всех точках системы давления и температуры одинаковы. Система, выведенная из состояния равновесия и предоставленная при постоянных параметрах окружающей среды самой себе, через некоторое время вновь придет в равновесное состояние, соответствующее этим параметрам. Процесс, проходящий через чередующиеся равновесные состояния системы называется равновесным процессом.
В противном случае система неравновесна. Все процессы, протекающие в реальном времени, как правило, неравновесны. Допущение о существовании равновесных систем основано на том, что любая система, выведенная из состояния равновесия и предоставленная при постоянных параметрах окружающей среды самой себе, через некоторое время вновь придет в равновесное состояние. Такое самопроизвольное (без внешнего воздействия) возвращение системы в состояние равновесия называется релаксацией, а промежуток времени, в течение которого реальная система возвращается в состояние равновесия, называется временем релаксации. Если реальный процесс протекает медленнее, чем идёт релаксация, то процесс является равновесным. Дли разных процессов и разных параметров время релаксации различно. Внутренними процессами, компенсирующими нарушение равновесия при изменение состояния тела и восстанавливающими термодинамическое равновесие, являются элементарные процессы обмена энергией при столкновении молекул.
Интересно отметить, что превращение энергии поступательного движения молекул в энергию вращательного движения и обратно при столкновении молекул происходит весьма быстро. Так, давление в объёме выравнивается со скоростью звука (более 340 м/с в воздухе при нормальных физических условиях). Температура – значительно медленнее. Связано это с тем, что превращение энергии поступательного или вращательного движения молекул в колебательное при росте температуры осуществляется сравнительно медленно. Вообще все процессы обмена энергии, в которых участвуют колебательные степени свободы движения молекул, требуют для своего осуществления сравнительно большого времени.
Рассмотрим, например, процесс сжатия газа в цилиндре. Если время смещения поршня от одного положения до другого существенно превышает время релаксации, то в процессе перемещения поршня давление и температура успеют выровняться по всему объему цилиндра. Это выравнивание обеспечивается непрерывным столкновением молекул, в результате чего подводимая от поршня к газу энергия достаточно быстро и равномерно распределяется между ними. Если последующие смещения поршня будут происходить аналогичным образом, то состояние системы в каждый момент времени будет практически равновесным.
Теоретически равновесный процесс можно осуществить только при бесконечно медленном изменении состояний системы и внешних условий. В этом смысле время как действующий физический фактор в равновесных процессах не применяется.
Уравнение состояния F (Р, v, Т) = 0 в трёхосной системе координат Р, v и Т представляют собой поверхность, называемую термодинамической поверхностью. Если рассечь эту поверхность (рис. 1.8) плоскостями параллельными осям координат, то получим кривые. Например, сечение плоскостью Т = const даёт линию изменения давления в зависимости от объёма в координатах Р и v, Описываемый процесс называется изотермным.
В термодинамике чаще всего применяют двухосную систему с координатами Р и v (рис. 1.9).
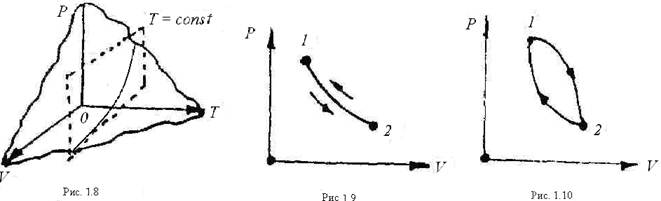 |
Процесс может быть прямым и обратным. Если система с параметрами Р1 и v1 (точка 1) переходит в состояние 2 с параметрами Р2 и v2, а затем возвращается в состояние 1, то такой процесс называется обратимым (рис. 1.9). Обратимым называется равновесный процесс, проходящий в прямом и обратном направлениях через ряд одинаковых состояний. В обратной последовательности состояний равновесного процесса рабочее тело и внешняя среда возвращаются в исходное состояние.
Процессы, не соответствующие этому условию, называются необратимыми. Все реальные процессы необратимы.
В начальном курсе термодинамики рассматриваются равновесные обратимые процессы, происходящие в закрытых (ΔМ = 0) системах:
1) изохорный, протекающий при неизменном объеме (v = const);
2) изобарный, протекающий при неизменном давлении (p = const);
3) изотермный, протекающий при неизменной температуре (Т = const);
4) адиабатный, совершающийся при отсутствии теплообмена (ΔQ =0);
5) политропный, обобщающий, процесс, частными случаями котоpoгo являются первые четыре процесса.
Особое значение имеют замкнутые процессы (или круговые). Это такие процессы, при которых система проходит ряд последовательных состояний, возвращаясь к первоначальному. Иначе такой процесс называется циклом (рис. 1.10).
2.1.Теплоёмкость идеальных газов
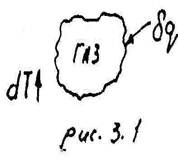 Если возьмём любое рабочее тело и сообщим ему тепло в любом процессе, то изменяется его состояние, например, в частном случае, увеличивается его температура. (рис.3.1).
Если возьмём любое рабочее тело и сообщим ему тепло в любом процессе, то изменяется его состояние, например, в частном случае, увеличивается его температура. (рис.3.1).
Отношение элементарного количества теплоты δQ, полученного телом при бесконечно малом изменении его состояния, к связанному с этим изменению температуры тела dT называется теплоёмкостью рабочего тела в данном процессе:
C = δQ/dT. (1)
(Причина применения разных символов δ или d приэлементарных количествах теплоты и температуры будет объяснена ниже).
Изменение температуры тела при одном и том же количестве сообщаемой теплоты зависит от характера происходящего при этом процесса, поэтому теплоемкость является функцией процесса. Это означает, что одно и то же рабочее тело в зависимости от процесса требует для своего нагревания на 1 К различного количества теплоты. Численно величина с изменяется в пределах от + ∞ до — ∞. При этом разница является суммой разниц внутренней энергии и работ процессов.
Обычно теплоемкость относят к единице количества вещества (отсюда название - удельная теплоёмкость) и в зависимости от выбранной единицы различают:
- удельную массовую теплоёмкость с, отнесенную к 1 кг вещества, Дж/(кг-К);
- удельную объёмную теплоёмкость с', отнесенную к количеству вещества, содержащегося в 1 м3 объема при нормальных физических условиях, Дж/(м3-К);
- удельную мольную теплоёмкость сμ, отнесенную к одному киломолю вещества, Дж/(кмоль-К).
Массовая удельная теплоёмкость (с) равна:
с = сх / m, [Дж / (кг • К)].
Объёмная удельная теплоёмкость с' - это отношение теплоёмкости однородного
тела к его объёму при нормальных условиях.
с' = cx/V0, [Дж/(м3-К)],
где V0 - объём произвольного количества газа при нормальных физических условиях.
Молярная теплоёмкость µс равна:.
µс [Дж / (моль • К)], µ - молярная масса вещества [кг / моль].
Зависимость между удельными теплоёмкостями устанавливается очевидными соотношениями:
с' = с • ρн; cμ =c • μ или c = µc/µ = c’/po =c’·22,414/µ
Здесь ρ н — плотность газа при нормальных условиях, [кг / м3].
Из уравнения (1): δqx = сх · dТ
можно найти количество тепла, сообщённого телу в течение процесса
Тогда:
2 T2
∫ δqx = q1,2 = ∫ cx · dT.
1 T1
Изохорная теплоёмкость
В термодинамических расчетах большое значение имеет теплоемкость при постоянном объеме
cv = δqv / dTv. (2)
Она равна отношению количества теплоты δqv, подведенной к телу в процессе при постоянном объеме, к изменению температуры тела dТv;
- теплоемкость при постоянном давлении
cр =δqp / dT p (10)
и равная отношению количества теплоты δqp,сообщенной телу в процессе при постоянном давлении, к изменению температуры тела dTp.
| Теплоёмкость некоторых газов при температуре 0 0С | |||
| Газ | Число степеней свободы | Мольная тепло- емкость, кДж/ (кмоль- К) | k=Cр / Cv |
| Гелий Не | 3 | 12,60 | 1,660 |
| Аргон Аr | 3 | 12,48 | 1,660 |
| Кислород О2 | 5 | 20,96 | 1,397 |
| Водород Н2 | 5 | 20,30 | 1,410 |
| Азот N2 | 5 | 20,80 | 1,400 |
| Метан СH4 | 6 | 26,42 | 1,315 |
| Аммиак NH3 | 6 | 26,67 | 1,313 |
| Диоксид угле- рода СО2 | 6 | 27,55 | 1,302 |
| Перегретый водяной пар Н2О | 6 | 1,30 |
Обычно теплоемкости определяются экспериментально, но для многих веществ их можно рассчитать методами статистической физики. Числовое значение теплоемкости идеального газа позволяет найти классическая теория теплоемкости, основанная на теореме о равномерном распределении энергии по степеням свободы молекул. Согласно этой теореме внутренняя энергия идеального газа прямо пропорциональна числу степеней свободы молекул и энергии kT/2, приходящейся на одну степень свободы. Здесь k является коэффициентом пропорциональности и называется постоянной Больцмана (австрийский физик Людвиг Больцман, 1844-1906), равной 1,380∙10-23 Дж/К. Число степеней свободы позволяют полностью определить положение молекулы в пространстве.
Молекула одноатомного газа имеет три степени свободы соответственно трем составляющим в направлении координатных осей, на которые может быть разложено поступательное движение. Молекула двухатомного газа имеет пять степеней свободы, так как помимо поступательного движения она может вращаться около двух осей, перпендикулярных линии, соединяющей атомы. Молекула трехатомного и вообще многоатомного газа имеет шесть степеней свободы: три поступательных и три вращательных.
Результаты классической теории теплоемкости достаточно хорошо согласуются с экспериментальными данными в области комнатных температур, однако основной вывод о независимости от температуры эксперимент не подтверждает. Расхождения, особенно существенные в области низких и достаточно высоких температур, связаны с квантовым поведением молекул и находят объяснения в рамках квантовой теории теплоемкости.
С уменьшением температуры газа происходит «вымораживание» числа степеней свободы молекул. Так, для двухатомной молекулы происходит «вымораживание» вращательных степеней свободы и она вместо пяти имеет три степени свободы, а следовательно, и меньшую внутреннюю энергию и теплоемкость. С увеличением температуры у многоатомных молекул происходит возбуждение внутренних степеней свободы за счет возникновения колебательного движения атомов молекулы (молекула становится осциллятором). Это приводит к увеличению внутренней энергии, а следовательно, и теплоемкости с ростом температуры.
Выведем уравнение изохорной теплоёмкости. Первый закон термодинамики для равновесного процесса записывается так:
δq = du + p • dv (3)
Так как удельная внутренняя энергия u является полным дифференциалом, то можно её определить в зависимости от двух любых параметров, например от Т и v: и = f (T, v), тогда можно записать;
du = (∂u/∂T)v • dT + (∂u/∂υ)т • dυ (4)
Подставим значение du из (4) в уравнение'(3):
δq = (∂u/∂T)v · dT + (∂u/∂υ)т · dυ + p · dυ
или
δq = (∂u/∂T)v · dT + [p + (∂u/∂υ)т] · dυ (4')
Так как в изохорном процессе υ = const, то dυ = 0. Тогда имеем:
δqv = (∂u/∂T)v · dTv, (5)
а теплоёмкость в изохорном процессе равна:
cv = δqv/dTv = (δu/∂T)v · (dTv/dTv) = (∂u/∂T)v (6)
cv = (∂u/∂T)v (6’)
Используя выражения (3), (5), (6) можно записать:
δqv = duv = cv · dTv (7)
To есть в процессе при v = const, когда тело не совершает внешней работы вся теплота, подведённая к телу расходуется на изменение его удельной внутренней энергии.
Принимая сv = const, можно записать из (7):
q1-2, v = u2 – u1 = cv · (T2 – T1) (8)
Таким образом, изменение удельной внутренней энергии идеального газа равно произведению теплоёмкости сv при постоянном объеме, на разность температур тела.
Из уравнения (4') при р = const имеем:
δqp = (ди/ дТ)V · dTp + [ р + (ди / дυ)т ] • dυP (9)
Учитывая выражение (9) можно записать:
Ср = (ди/ дТ)v + [ р + (ди / дυ)т ] • (дυ/dT)р
Используя уравнение (6’) запишем:
cp = cv + [ р + (ди / дυ)т ] • (дυ/dT)р (11)
Для идеального газа. (дu / дv)T= 0, а так как R = р · v I T, то
дифференцируя его при р = const, имеем:
R = p · (dυ/dT)p, (12)
Подставляя (12) в (11) имеем окончательно:
ср = cv + R. (13)
Для реальных газов ср - cv> R, так как при расширении (при р = const) совершается не только внешняя, но и внутренняя работа, связанная с изменением внутренней потенциальной энергией газа, что вызывает дополнительный расход теплоты.
 2014-02-09
2014-02-09 10086
10086