Закон сохранения и превращения энергии
Обобщённую формулировку этого закона дал М.В. Ломоносов Уменьшение какого-либо вида энергиив одной системе должно сопровождаться увеличением энергии в другой системе тел.
В 1842 году Р. Майер установил зависимость между затраченной теплотой Q и получаемой работой L: Q - А • L, [Дж] где А – постоянная величина (тепловой эквивалент работы). Величина А зависит от системы единиц, выбранной для измерения теплоты и работы. В системе СИ А = 1.
Работой называется передача энергии от одного тела к другому. Работа сопровождается изменением объёма рабочего тела, перемещением его в пространстве или изменением его положения.
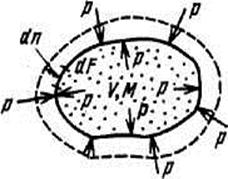 |
| Рис. 1. К определению работы расширения |
Из рис. 1 ясно, что если силы р внутри системы больше, чем снаружи, то поверхность системы увеличивается на величину dn и система совершает элементарную работу pdFdn. Общая работа при этом составит 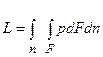 . Если учесть, что произведение под интегралом равно элементарному объёму dV, то элементарное количество работы
. Если учесть, что произведение под интегралом равно элементарному объёму dV, то элементарное количество работы 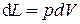 . Если dV > 0, то и L > 0, т.е. в этом случае система расширяется и работа, совершаемая рабочим телом системы, является также положительной величиной. Поскольку расширению системы соответствует положительная работа, то L получила название работы расширения (или внешней). Очевидно, что если dV < 0, то и работа расширения отрицательна. Работа расширения происходит в закрытых системах.
. Если dV > 0, то и L > 0, т.е. в этом случае система расширяется и работа, совершаемая рабочим телом системы, является также положительной величиной. Поскольку расширению системы соответствует положительная работа, то L получила название работы расширения (или внешней). Очевидно, что если dV < 0, то и работа расширения отрицательна. Работа расширения происходит в закрытых системах.
Рассмотрим случай получения работы в равновесном процессе при Р = const в Р- v координатах (рис.2.2).
Возьмём систему, состоящую из цилиндра, в котором перемещается поршень под действием давления Р1. Будем считать, что поршень имеет площадь f, а газ удельный объём v 1. Если давление окружающей среды Р2, то газ в системе будет расширяться и переместит поршень из положения А в положение В. При этом поршень пройдёт расстояние равное S. Тогда работа, совершаемая газом при перемещении поршня на величину S равна:
L= Р · f•S
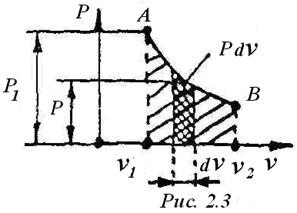 |
Произведение f •S = v2- v2 = Δ v, тогда L = Р • Δ v.
Элементарная удельная работа δL при бесконечно малом изменении объёма dv равна: δL= Р• dv. Это выражение не является полным дифференциалом переменных Р и v, поэтому в термодинамике принято элементарную удельную работу обозначать δL. После интегрирования выражения δL= Р• dv получим удельную работу при конечном изменении объёма от v 1 до v 2:
2 υ2
L1,2 = ∫ δL = ∫ P dυ.
1 υ1
Если имеется процесс расширения АВ в координатах Р-v, то площадь под этой кривой, равная ABv2 v1A численно представляет собой работу, совершённую газом при перемещении поршня източки А в точку В в процессе АВ (рис.2.3). Поскольку расширению системы соответствует положительная работа, то L получила название работы расширения (или внешней). Таким образом, элементарное количество удельной работы расширения равно
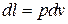
Из рис.2.3. следует, что работа процесса зависит от формы кривой протекания процесса. Поэтому работа в термодинамике относится к функциям процесса.
Если рабочее тело совершает круговой процесс (1, а, 2, в, 1, рис.2.4), то при его рас-
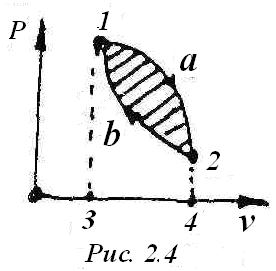 |
-ширении по линии I, а, 2 совершается
положительная работа, равная по площади: 1, а, 2, 4, 3, 1.
При сжатии по линии 2, в, 1 над телом совершается работа, равная по площади 2, в, 1, 3, 4, 2. Эта работа отрицательная. Разность площадей даёт суммарную работу, совершённую рабочим телом в результате одного цикла. Эта работа равна заштрихованной площади 1, а, 2, в, 1.
В открытых системах, где в системе движется поток рабочего тела (например, в турбинах или компрессорах), работа называется технической или располагаемой. В обозначение технической работы вводится нижний индекс, например, L тех или L расп.
Элементарное количество удельной технической работы равно
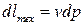 .
.
Здесь элементарному количеству технической работы соответствует элементарное приращение давления.
 2014-02-09
2014-02-09 1544
1544
