Первое начало термодинамики.
Утверждаю
Начальник кафедры физики
профессор,д.х.н.
заслуженный работник
Высшей школы РФ
Ю.В.Спичкин
“___”______________2007 г
ФОНДОВАЯ ЛЕКЦИЯ
По дисциплине “Физика”
Тема № 33 Лекция№ 1 “Основы термодинамики ”
Разработал: доцент кафедры физики
кадидат физико-математичеких наук
подполковник милиции СычевИ.В.
Воронеж 2007 г.
СОДЕРЖАНИЕ
1. Основные положения и определения.
3. Теплоемкость.
4. Внутренняя энергия идеального газа.
5. Изопроцессы.
6. Теорема Карно.
7. Второе начало термодинамики.
8. Неравенство Клаузиуса.
9. Энтропия. Свободная энергия.
10. Статистический смысл энтропии. Формула Больцмана.
11. Третье начало термодинамики.
ОСНОВЫ ТЕРМОДИНАМИКИ
Два подхода к изучению вещества. Термодинамический подход заключается в установлении связей и соотношений между экспериментально определяемыми (феноменологическими) параметрами (их называют термодинамическими параметрами), опираясь на несколько постулатов (начал термодинамики).
Статистический подход опирается на молекулярно-кинетические представления о строении вещества (основные положения молекулярно-кинетической теории):
1. Все тела состоят из огромного числа мельчайших частичек вещества—атомов и молекул.
2. Молекулы вещества находятся в непрерывном хаотическом движении.
3. Молекулы взаимодействуют между собой: на больших расстояниях притягиваются, на малых отталкиваются.
Термодинамические параметры вычисляются в рамках конкретной модели внутреннего строения вещества (т.е. модели движения и взаимодействия атомов и молекул), посредством усреднения по огромному числу состояний системы. Статистическая физика использует методы теории вероятностей и математической статистики. Классическая теория опирается на классические законы движения молекул, квантовая статистика— на законы квантовой механики.
Количество вещества. Моль. Количество вещества в системе, т.е. число содержащихся в ней структурных единиц — атомов или молекул, измеряется в молях. Моль любого вещества содержит определенное число молекул, называемое числом Авогадро, равное числу атомов в 12 г углерода: NА ≈ 6,02•1023моль -1. Для числа молей получим:
ν =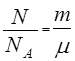 , (1)
, (1)
где N — число молекул в системе, m = m0 N — масса системы (m0 — масса одной молекулы), μ = m0 NA — молярная масса вещества.
Равновесные и неравновесные состояния. Уравнение состояния. Термодинамическая система, находящаяся при неизменных внешних условиях, приходит в равновесное состояние, в котором отсутствуют потоки любого типа (например, потоки массы и энергии). Термодинамические параметры равновесного состояния (давление р, температура Т, объем V или плотность r, молярная масса m и др.) связаны уравнением состояния. Уравнение состояния идеального газа (уравнение Клапейрона — Менделеева)
pV = vRT, (2)
где R ≈8, 31 Дж/моль•К) — универсальная газовая постоянная, было получено эмпирически и хорошо выполняется для разреженных газов.
Уравнение Ван-дер-Ваальса
(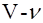 b) (p+
b) (p+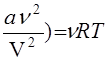 (3)
(3)
является одним из приближенных уравнений состояния реальных плотных газов. Процесс изменения состояния называют равновесным (квазиравновесным), если он происходит столь медленно, что каждое промежуточное состояние можно считать равновесным. Равновесные процессы являются обратимыми.
Равновесная термодинамика рассматривает равновесные состояния и процессы. Она позволяет сделать ряд выводов о характере и направлении протекания неравновесных процессов, происходящих между начальным и конечным равновесными состояниями, но не дает количественного описания этих процессов. Неравновесные системы — предмет физической кинетики и неравновесной термодинамики. Отметим, что время прихода в равновесие (время релаксации) уменьшается вместе с размерами системы, поэтому можно говорить о локальном равновесии в маленькой части неравновесной системы (например, вводить температуру, меняющуюся от точки к точке).
Простые термодинамические системы. Однородная и изотропная термодинамическая система, химический состав которой не меняется, называется (термодинамически) простой. К простым системам относятся, в частности, однокомпонентные (чистые) газы и жидкости. Простая система обладает двумя степенями свободы, т.е. только два ее термодинамических параметра можно считать независимыми. Равновесные состояния простой системы можно изображать точками на плоскости (например, в координатах (р, V)), равновесные процессы — линиями на этой плоскости. Работа, совершаемая простой системой против внешних сил, равна
δA = pdV, A = 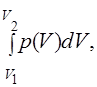 (4)
(4)
где p(V) называется уравнением процесса. Так как работа не является функцией состояния, то бесконечно малая работа обозначена δА, чтобы отличить ее от бесконечно малого изменения функции (дифференциала).
Наличие связи между любыми тремя параметрами простой системы, налагаемой уравнением состояния, приводит также к связи между их производными. Выразив изменение Т через изменения р и V:
dT=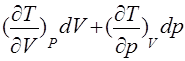 (5)
(5)
и применив это выражение к изотермическому процессу (dT = 0), получим
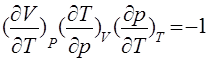 (6)
(6)
Это соотношение связывает между собой три коэффициента:

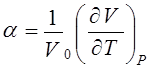 (температурный коэффициент объемного расширения),
(температурный коэффициент объемного расширения),
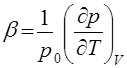 (температурный коэффициент давления),
(температурный коэффициент давления),
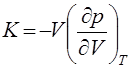 (изотермический модуль всестороннего сжатия).
(изотермический модуль всестороннего сжатия).
 2014-02-09
2014-02-09 497
497







