1. Процесс с постоянной теплоемкостью. Изменение энтропии при изменении температуры от Т1 до Т2 равно
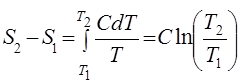 (31)
(31)
2. Энтропия идеального газа. Подставляя в (30) выражение для внутренней энергии идеального газа (15), с учетом уравнения состояния pV=vRT получим
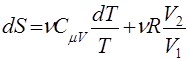
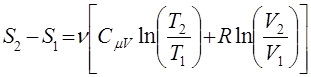 (32)
(32)
Иногда условно записывают S = v(CmV ln Т + R ln V), имея в виду, что в приложениях всегда возникает разность энтропии.
3. Энтропия газа Ван-дер-Ваальса. Подставляя в (30) зависимость U=CV T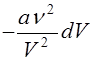 , с учетом уравнения состояния (3) имеем
, с учетом уравнения состояния (3) имеем
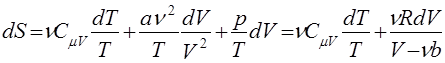 , (33)
, (33)
S=n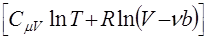
Направление неравновесных процессов в теплоизолированной системе. Рассмотрим неравновесный процесс, переводящий систему из равновесного состояния 1 в равновесное состояние 2. Организуем циклический процесс, вернувшись из 2 в 1 при помощи любого равновесного процесса. Запишем для этого цикла неравенство Клаузиуса (27) и для равновесного процесса учтем определение энтропии (29). Получим:
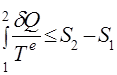 (34)
(34)
Если неравновесный процесс происходит в адиабатической оболочке, то левая часть равенства обращается в нуль, что дает
S2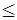 S1 (35)
S1 (35)
т. е. в любом процессе без подвода тепла энтропия не убывает. Равновесное состояние теплоизолированной системы соответствует максимуму энтропии.
 2014-02-09
2014-02-09 925
925








