Внутренняя энергия. Теплообмен. Температура. В отличие от механической энергии, которая может изменяться только за счет работы, внутренняя энергия может изменяться как за счет работы, так и при контакте с телами, имеющими другую температуру, т. е. в процессе теплообмена. Энергия, переданная при теплообмене (подведении тепла), называется количеством теплоты или теплотой и обозначается Q. Теплота считается положительной, если система получает энергию, и отрицательной, если отдает.
При теплообмене энергия переходит от тела с большей температурой к телу с меньшей температурой. Любая температурная шкала должна удовлетворять этому свойству. Эмпирические температурные шкалы основаны на косвенных измерениях, т.е. на измерениях параметров, монотонно зависящих от температуры. Газовая шкала температур опирается на уравнение состояния идеального газа (2). Термодинамическая, или абсолютная шкала температур определяется на основе второго начала термодинамики.
С точки зрения классической молекулярно-кинетической теории, внутренняя энергия термодинамической системы равна сумме кинетической энергии движения ее молекул и потенциальной энергии их взаимодействия. Внутренняя энергия U = U(V, Т…) — функция состояния термодинамической системы, она является важнейшей характеристикой термодинамической системы. Зависимость U = U(V, Т,...) называют калорическим уравнением состояния, в отличие от термического уравнения состояния р=p(V,Т).
Термодинамика должна определять любую величину феноменологически, вне зависимости от представлений о внутреннем устройстве вещества. Принципиальную возможность такого определения дает представление о гибкой адиабатической оболочке, которая позволяет изменять форму системы и совершать над ней работу, но исключает ее теплообмен с внешними телами. В этом случае работа внешних сил А при переходе системы из состояния 1 в состояние 2 не зависит от процесса перехода, а зависит только от начального и конечного состояний системы, что позволяет определить разность внутренних энергий следующим образом: U2 — U1 = Ае (1 ® 2).
Первое начало термодинамики. Общий закон сохранения энергии с учетом процесса теплообмена и внутренней энергии имеет вид:
DЕмех +DU = Аe + Q, (7)
т.е. изменение полной (механической+внутренней) энергии системы равно работе внешних сил и теплоте, полученной при теплообмене с внешними телами. Иногда закон сохранения энергии формулируют как невозможность создания вечного двигателя первого рода (который производил бы работу из ничего). Первым началом термодинамики называют обычно применение этого закона к термодинамической системе, механическая энергия которой не меняется. Кроме того, в термодинамике удобнее использовать работу системы против внешних сил: А = —Аe. Получаем
Q = DU + A, (8)
т. е. подведенная к термодинамической системе теплота идет на изменение ее внутренней энергии и на совершение системой работы против внешних сил.
Первое начало для простой системы. Теплоемкость. Используя уравнение (4), запишем первое начало термодинамики для простой системы, получившей бесконечно малое количества теплоты:
dQ = dU + p dV (9)
Отношение dQ к изменению температуры dT называют теплоемкостью системы С в данном равновесном процессе (измеряется в Дж/К):
CdT = dU + pdV. (10)
Считая U в (7) функцией двух переменных (V, Т), запишем
dU=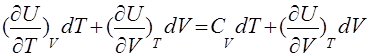 (11)
(11)
где СV = 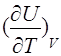 — теплоемкость при постоянном объеме (см. уравнение (7)). Получаем:
— теплоемкость при постоянном объеме (см. уравнение (7)). Получаем:
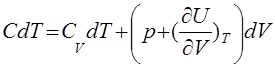 (12)
(12)
Отсюда видно, что теплоемкость для процесса V (Т) зависит от значения производной dV/dT. Так как параметры (V, Т) можно менять независимо, то эта производная, а значит, и теплоемкость в данной точке может иметь любое значение.
Энтальпия. Процесс Джоуля — Томсона. Если равновесный процесс изменения состояния происходит при постоянном давлении, то подведенная теплота
Q = DU + pDV =D (U + pV) = DI (p = const) (13)
равна разности энтальпий I = U + pV в конечном и начальном состояниях. Энтальпия используется также для описания процесса Джоуля — Томсона — стационарного просачивания вещества сквозь пористую перегородку (дросселирования). Этот процесс применяется для получения сверхнизких температур. В процессе Джоуля — Томсона сохраняется энтальпия вещества, прошедшего сквозь перегородку:
U1 + p1 V1= U2 + p2 V2 (14)
Внутренняя энергия идеального газа. Внутренняя энергия идеального газа зависит только от его температуры. Существуют экспериментальные подтверждения этому факту:
1.При расширении газа в пустоту внутри жесткой адиабатической оболочки равны нулю как работа газа А, так и полученная теплота Q, а следовательно, и DU; было обнаружено, что в этом неравновесном процессе температура идеального газа не меняется (опыты Гей-Люссака и Джоуля).
2.Температура идеального газа не меняется в процессе Джоуля — Томсона. Второе начало термодинамики позволяет доказать уравнение
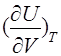 =0, исходя из термического уравнения состояния (2).
=0, исходя из термического уравнения состояния (2).
Процессы в идеальном газе. Из уравнений (10), (11) получим изменение внутренней энергии и первое начало термодинамики для идеального газа:
dU = CVdT, dQ = CVdT + pdV. (15)
Эксперименты показывают, что в широких пределах изменения температуры СV не зависит от Т, и можно записать U = СVТ + const. Рассмотрим конкретные процессы.
1 )Изотермический процесс (dT = 0). В этом случае dU = 0, т. е.
dQ = pdV, Q = A =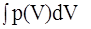 = nRT ln
= nRT ln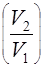 . (16)
. (16)
Теплоемкость данного процесса можно считать равной бесконечности.
2) Изобарный процесс (dp = 0). Вводя теплоемкость при постоянном давлении, с учетом уравнения состояния (2) получим
Ср dT = CV dT + р dV = CV dT + nR dT (17)
Сокращая на dT, получим соотношения между теплоемкостями (уравнение Майера):
Ср = CV + nR, сp =cV +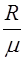 , Сm p=С m V +R (18)
, Сm p=С m V +R (18)
где с = С /m — удельная теплоемкость, а Сm = С/m — молярная теплоемкость газа (измеряются в Дж/(кг•К) и Дж/(моль•К) соответственно).
3) Адиабатический процесс. Если равновесный процесс происходит без подвода тепла (d Q = 0), то
CV dT = -pdV => n Cm V dT= - 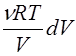 Þ
Þ
Þ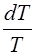 =
=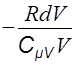 (19)
(19)
Интегрируя, получим уравнение адиабатического процесса (уравнение Пуассона):
TV γ-1 = const. или pV γ = const, (20)
где безразмерный параметр γ= Ср/СV = 1 + (R/CμV) называется показателем адиабаты. Через γ с учетом уравнения Майера (18), можно выразить теплоемкости газа:
Cm V =
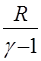 , Cm p =
, Cm p =
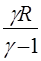 (21)
(21)
4) Политропный процесс. Политропным называется процесс, теплоемкость которого постоянна (С = const):
С dT = CV dT + р dV Þ (CV –C)dT =-p dV (22)
Проведя такие же вычисления, как для адиабатического процесса, получим уравнение политропного процесс а:
pV n = const, (23)
где n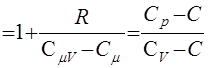 - показатель политропы.
- показатель политропы.
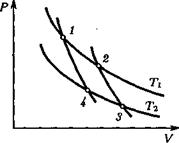
5) Цикл Карно. Циклом Карно называется замкнутый цикл, состоящий из двух изотерм (при температурах Т1 и Т2, T1 > Т2) и двух адиабат. Коэффициентом полезного действия замкнутого цикла называют величину
h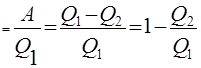 (24)
(24)
где A — работа за цикл, Q1 — теплота, полученная от нагревателя, Q2 — теплота, отданная холодильнику. В замкнутом цикле DU = 0, поэтому Q1–Q2=A
Для цикла Карно (рис. 1) из уравнения (16) имеем:
 Q1
Q1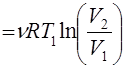 , Q2
, Q2 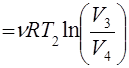
Из уравнения Пуассона (14) находим:
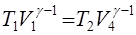 ,
,
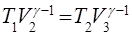 .
.
Отсюда следует, что V2/V1 = V3/V4 Поэтому для КПД получим:
h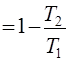 (25)
(25)
т.е. КПД цикла Карно зависит только от отношения температур холодильника и нагревателя.
 2014-02-09
2014-02-09 1895
1895
