Кинетическая теория идеального газа
идеального газа.
С точки зрения молекулярно-кинетической теории, газ считается идеальным, если можно пренебречь потенциальной энергией взаимодействия его молекул (по сравнению с кинетической энергией) и размерами молекул (по сравнению со средним расстоянием между ними). Давление газа на стенку возникает в результате многочисленных упругих соударений молекул между собой и со стенками сосуда. (Удары можно считать в среднем упругими, так как газ находится со стенкой в тепловом равновесии.) Основное уравнение кинетической теории идеального газа выражает давление через средний квадрат скорости молекул:
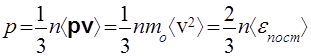 (40)
(40)
где n = N/V — концентрация молекул, mO — масса одной молекулы,
р = m0 v — ее импульс, 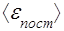 =
=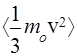 — средняя кинетическая энергия поступательного движения молекулы.
— средняя кинетическая энергия поступательного движения молекулы.
Если связь энергии и импульса отличается от классической, то последнее равенство в (40) приобретает иной вид. Для газа фотонов имеем р = e/с. В результате получим
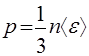 (41)
(41)
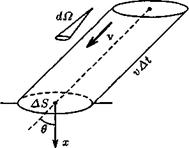
Число ударов о стенку. Число молекул DN, попадающих за время Dt на плоский участок поверхности площадью DS, равно
 |
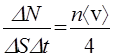 (42)
(42)
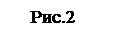 Формулы для вычислений. Формулы для переноса через площадку числа частиц, импульса, энергии и т. д. получают разбиением молекул на удобные группы и расчетом их вклада в вычисляемую величину. Наиболее общий подход — разбиение на группы, имеющие почти одинаковую скорость v. Выделим группу молекул, имеющих величину скорости от v до v + dv и направление в телесном угле dW. Число молекул данной группы в единице объема равно dn(v, v+ +dv; dfi) = dn(v, v + dv)df2/4n. Чтобы найти, сколько молекул данной группы попадает на плоский участок площадью D S за время D t, надо построить на этом участке косой цилиндр (рис.2), направляющая которого имеет длину vDt и составляет угол q с осью х. Все молекулы выделенной группы, находящиеся в этом цилиндре (и только они!), попадут на площадку D S за время D t. Производя последовательные интегрирования, можно вывести (42) и многие другие формулы, например, для энергии, проносимой через площадку:
Формулы для вычислений. Формулы для переноса через площадку числа частиц, импульса, энергии и т. д. получают разбиением молекул на удобные группы и расчетом их вклада в вычисляемую величину. Наиболее общий подход — разбиение на группы, имеющие почти одинаковую скорость v. Выделим группу молекул, имеющих величину скорости от v до v + dv и направление в телесном угле dW. Число молекул данной группы в единице объема равно dn(v, v+ +dv; dfi) = dn(v, v + dv)df2/4n. Чтобы найти, сколько молекул данной группы попадает на плоский участок площадью D S за время D t, надо построить на этом участке косой цилиндр (рис.2), направляющая которого имеет длину vDt и составляет угол q с осью х. Все молекулы выделенной группы, находящиеся в этом цилиндре (и только они!), попадут на площадку D S за время D t. Производя последовательные интегрирования, можно вывести (42) и многие другие формулы, например, для энергии, проносимой через площадку:
Определение температуры в кинетической теории газов. В кинетической теории газов доказывается, что если две подсистемы (из одинаковых или разных молекул) могут обмениваться энергией, то в состоянии равновесия оказываются равными средние кинетические энергии поступательного движения их молекул. Исходя из этого, кинетическая теория газов определяет температуру как величину, пропорциональную средней кинетической энергии поступательного движения молекулы:
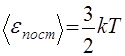 (43)
(43)
где k — постоянная Больцмана, которая выражается через универсальную газовую постоянную и число Авогадро (см. разд. 2.1): k = R/Na ~1,38•10 -23 Дж/К. Коэффициент пропорциональности выбран так, чтобы уравнение состояния идеального газа
р = nkT = 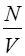 kT (44)
kT (44)
(оно получается из основного уравнения (33) и определения температуры (37)) совпадало с уравнением (2), в котором используется газовая шкала температур.
Средняя квадратичная скорость поступательного движения молекул с учетом (40) и (43) вычисляется по формулам
Vкв. =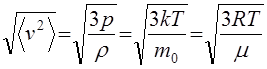 (45)
(45)
где r = т0 п — плотность газа.
Внутренняя энергия идеального газа. Важной характеристикой идеального газа является число степеней свободы его молекулы. У одноатомной молекулы есть только три степени свободы, соответствующие поступательному движению: i=iп = 3. У жесткой двухатомной молекулы, кроме поступательных, есть еще две вращательные степени свободы (полярные углы, задающие ее направление в пространстве):: i=iп + iвр =3+2=5. У жесткой многоатомной (нелинейной) молекулы — три вращательные степени свободы, поэтому i = 6. В классической статистической физике доказывается теорема о равнораспределении энергии по степеням свободы: на любую степень свободы, которой в выражении для энергии молекулы соответствует член ах2 или bх2, приходится средняя энергия – 1/2 kT в расчете на одну молекулу. Формула (43) находится в полном соответствии с утверждением этой теоремы. Средняя энергия одной молекулы и внутренняя энергия всего газа принимают вид:
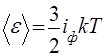 ,
, 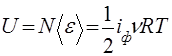 (46)
(46)
Физическое число степеней свободы iФ в случае жестких молекул совпадает с математическим. Однако, когда оказываются возбужденными колебательные степени свободы (при Т ~ 103 К), то на каждую колебательную степень свободы будет приходиться (с учетом потенциальной энергии колебаний) средняя энергия kT. В результате получим iФ = iп + iвр + 2 iкол, где iко л обозначает математическое число колебательных степеней свободы. Для N -атомной молекулы iко л = 3 N — (in + iвр) (например, для мягкой двухатомной молекулы iф = 3 + 2 + 2(6 - 5) = 7).
Из (46) получим выражения для теплоемкостей идеального газа и его показателя адиабаты:
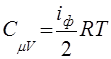 ,
, 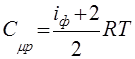 ,
, 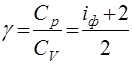 (47)
(47)
При комнатных температурах измеряемая теплоемкость соответствует модели жестких молекул — колебательные степени свободы оказываются невозбужденными или, как говорят, «замороженными». Однако при повышении температуры до ~ 103 К теплоемкость начинает возрастать, т. е. колебательные степени свободы «размораживаются». Наоборот, при понижении температуры до нескольких десятков кельвинов происходит «вымораживание» вращательных степеней свободы, сопровождающееся соответствующим уменьшением теплоемкостей. Объяснение явлению вымораживания степеней свободы, дает квантовая механика: если средняя энергия теплового движения kT мала по сравнению с расстоянием до ближайшего дискретного уровня, то данный вид движения не возбуждается.
Смесь идеальных газов. Закон Дальтона: давление смеси (двух) идеальны х газов равно сумме их парциальных давлений:
х газов равно сумме их парциальных давлений:
p = p1 + p2 = (n1 + n2) kT = (n 1+ v 2) RT.
Внутренняя энергия смеси равна сумме внутренних энергий U =
смеси равна сумме внутренних энергий U =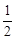 i1v1RT +
i1v1RT + 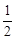 i2n 2RT • Эта формула позволяет ввести:
i2n 2RT • Эта формула позволяет ввести:
эффективное число степеней свободы: i (v1 + v2) = i 1 v1 + i 2 v2
эффективные молярные теплоемкости: (v1 + v2)Cm= v1Cm1 + v2 C m2
эффективную молярную массу: (v1 + v2)m= v1m1 + v2 m2
Распределение Максвелла. Распределение молекул по скоростям описывается следующими функциями:
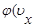 )d
)d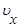 =
= 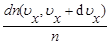
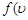 )d
)d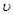 =
= 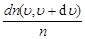
(42)
Ф (v) dux duy duz = 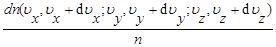
Определение любой функции распределения основано на утверждении, что доля молекул, попадающих (в среднем) в очень маленький интервал данной переменной (скорости, проекции скорости, энергии), пропорциональна ширине этого интервала (du обозначает физически, а не математически, бесконечно малый интервал — он должен содержать большое число молекул.) Среднюю долю молекул, обладающих некоторым признаком (например, попадающих в заданный интервал скоростей), можно трактовать как вероятность того, что произвольная молекула обладает данным признаком. Поэтому функцию распределения иногда называют плотностью вероятности.
Перечислим свойства функции распределения (на примере f (u)).
1) Доля частиц (вероятность) в конечном интервале(u1,u 2):
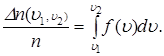
2)Нормированность:
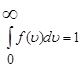
3) Вычисление среднего от любой функции скорости x(v):
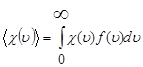
Между тремя функциями распределения, определенными в (42), существуют следующие связи:
f (u)= Ф (u)4 pu2 Ф(ux,uy,uz)=j(ux)j(uy)j(uz)
Функция j является четной функцией, т. е. можно написать: j=j(ux2). Функция Ф (v) зависит только от u2=ux2+u y2+uz2 .Связь между Ф и j удовлетворяется только функцией ) j(ux)=А exp(-x ux 2)Коэффициенты А и x определяются из двух условий: а)нормировки функции j,
б)требования, чтобы Ответ выглядит так:
j(ux)=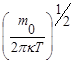 exp
exp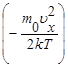
f(u)=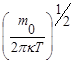 exp
exp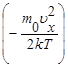 4 pu2
4 pu2
Обычно именно последнюю формулу называют распределением Максвелла (рис. 20). Функция f (u) достигает максимума при cкорости uв =(2кТ/m0 )1/2 которую называют наиболее вероятной скоростью. Значение функции f(u) в этой точке равно f(uВ) = 4е-1(2 pкТ / m 0)-1/2. Например, при увеличении Т в 4 раза максимальная скорость станет в 2 раза больше, а соответствующее значение функции f(uВ) - в 2 раза меньше; напомним, что площадь
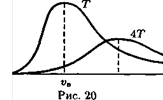
под кривой f(v) равна единице.
Средняя (или среднеарифметическая) скорость молекул вычисляется в соответствии с правилом (44):
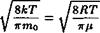 |
оо
(V) = J Vf(v)dv = О
Приведем также распределение молекул по энергиям поступательного движения:
.,., dn(e, E + de) 2
w(£) de = —— ———— - = —= n -у/я-
Интегралы для вычислений. Для вычисления средних величин с распределением Максвелла нужно уметь вычислять интегралы типа /„ = J^° x" exp(—jSx2) dx. Приведем два первых результата:
/о = -^/тг/?"1'2, /1 = -/?-1. Дальнейшие интегралы получим дифференцированием по /8. Например, /2 = ——— = -\/тг в~.
ар 4
Распределение Больцмана. Если газ находится во внешнем силовом поле, то концентрация молекул зависит от координат. Из условия механического равновесия газа можно получить:
п(г)=я(го)ехр -'•"»•"'•'. (46)
L K1 J
где еп(г) — потенциальная энергия молекулы во внешнем поле (распределение Больцмана). Частным случаем распределения Больцмана является барометрическая формула:
Поясним на примере барометрической формулы, как выводится распределение Больцмана. Условие равновесия в поле тяжести вертикального цилиндра с площадью основания s и высотой dh имеет вид: s dp = —p(s dh)g.
Отсюда с учетом уравнений р = nkT и р = топ получим — = — п.
 2014-02-09
2014-02-09 5257
5257
