Ориентация связей металл-лиганд определяет пространственную конфигурацию комплексных молекул а, следовательно, возможность существования их в виде изомеров, соединений с одинаковым составом и молекулярной массой, но отличающихся строением, физическими и химическими свойствами. У комплексных молекул с одинаковыми лигандами изомеры отсутствуют. Отталкиваясь за счёт электростатических сил, идентичные по природе лиганды, как правило, симметрично располагаются в пространстве вокруг центрального атома, где все положения лигандов эквивалентны. Возникает определенная устойчивая геометрическая конфигурация комплексного соединения. Для наиболее часто встречающихся комплексов с координационными числами 2, 4 и 6 свойственны следующие геометрические конфигурации:
| Координационное число | Геометрическая конфигурация | |||
| L ----------- M ---------- L – линейная Одинаковые лиганды находятся по разные стороны от комплексообразователя, с углом 1800. Наблюдается у лекарственного препарата золота (I) хризолана Na3[Au(S2O3)2], используемого при лечении ревматоидного артрита: [O3S2 – Au – S2O3]3-. Числу 2 отвечает sp-гибридизация. | ||||
 - тетраэдрическая По аналогии с катионом аммония (NH4+) лиганды в таких комплексных соединениях располагаются в вершинах тетраэдра. Чаще свойственна комплексообразователям со спаренными d-электронами и sp3-гибридизацией вакантных орбиталей. Проявляется у комплексной соли цинка [Zn(NH3)4]Cl2, с электронной формулой валентной оболочки катиона 3d104s04p0. - тетраэдрическая По аналогии с катионом аммония (NH4+) лиганды в таких комплексных соединениях располагаются в вершинах тетраэдра. Чаще свойственна комплексообразователям со спаренными d-электронами и sp3-гибридизацией вакантных орбиталей. Проявляется у комплексной соли цинка [Zn(NH3)4]Cl2, с электронной формулой валентной оболочки катиона 3d104s04p0. | ||||
 - плоская квадратная Характерна для [Cu(NH3)4]SO4 – комплекса, у которого из-за наличия неспаренного d-электрона у иона Cu2+ тетраэдрическое расположение лигандов сменяется на плоское квадратное. Наиболее часто встречаемый тип гибридизации dsp2. - плоская квадратная Характерна для [Cu(NH3)4]SO4 – комплекса, у которого из-за наличия неспаренного d-электрона у иона Cu2+ тетраэдрическое расположение лигандов сменяется на плоское квадратное. Наиболее часто встречаемый тип гибридизации dsp2. | ||||
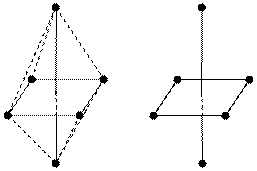
- октаэдрическая, схематически можно изобразить так:
Самая многочисленная группа комплексных соединений: Na2[SiF6], K2[PtCl6], H4[Mn(CN)6] и т.д., образуемых элементами V, VI и VII периодов таблицы Менделеева. Орбитали dz2 и dx2–y2 в эктаэдрических комплексах направлены прямо к лигандам, обеспечивая в итоге формирование гибридных d2sp3-орбиталей. |
При наличии двух или большего числа неоднородных лигандов эквивалентность расположения их во внутренней сфере комплексообразователя нарушается и возможно появление комплексных изомеров, различающихся по цвету, растворимости, реакционной способности, дипольному моменту, способам получения. Для комплексных соединений свойственны следующие типы изомерии: геометрическая, сольватная (в водных растворах гидратная), ионизационная, координационная и оптическая (зеркальная).
Геометрическая или пространственная изомерия заключается в том, что комплекс, включающий неодинаковые лиганды, может существовать в двух или нескольких различных формах в зависимости от пространственного размещения лигандов вокруг комплексообразователя. К геометрической изомерии в первую очередь относится цис-транс -изомерия, проявляющаяся в основном в плоско-квадратных и октаэдрических комплексах:
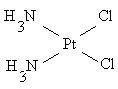
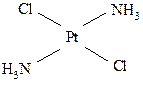
цис (оранжево-желтый) транс (светло-желтый)
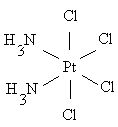
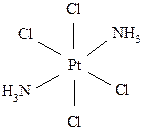
цис (оранжевый) транс (желтый)
Различие в структуре обусловливает различную физиологическую активность таких соединений. Например, малотоксичный плоско-квадратный цис-изомер платины обладает противоопухолевой активностью и нашёл применение в качестве лекарственного препарата; транс-изомер значительно более токсичен без какого-либо противоопухолевого действия.
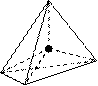
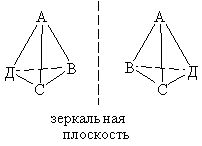 Оптическая изомерия. Наблюдается у комплексных соединений, структура которых не имеет элементов симметрии. В простейшем случае это тетраэдрический комплекс, с четырьмя различными лигандами, для которого существуют два изомера (см. схему), не совмещающиеся в пространстве. Такие изомеры называют оптическими антиподами. Один из оптических изомеров способен вращать плоскость поляризованного света влево (L-изомер), второй – вправо (D-изомер).
Оптическая изомерия. Наблюдается у комплексных соединений, структура которых не имеет элементов симметрии. В простейшем случае это тетраэдрический комплекс, с четырьмя различными лигандами, для которого существуют два изомера (см. схему), не совмещающиеся в пространстве. Такие изомеры называют оптическими антиподами. Один из оптических изомеров способен вращать плоскость поляризованного света влево (L-изомер), второй – вправо (D-изомер).
Другие виды изомерии вызваны различным положением и связью лигандов внутренней и внешней координационных сфер. Так, гидратная изомерия имеет место при переходе воды из внутренней во внешнюю сферу. Например, для хлорида хрома (III) известны три модификации:
| Структура комплекса | Окраска кристаллов |
| [Cr(H2O)6]Cl3 [Cr(H2O)5Cl]Cl2 ∙ H2O [Cr(H2O)4Cl2]Cl ∙ 2H2O | сине-серая светло-зеленая темно-зеленая |
Ионизационная изомерия обусловлена различным распределением неодинаковых по своей природе ионов между внутренней и внешней координационными сферами, что приводит к изменению степени диссоциации комплексного соединения. Например: [Co(NH3)5Br]SO4 – красно-фиолетовый; [Co(NH3)4SO4]Br – красный, в большей степени диссоциирующий комплекс.
Координационная изомерия связана с переходом лигандов от одного комплексообразователя к другому в соединениях, образованных комплексными катионами и комплексными анионами: [Co(NH3)6] ∙ [Cr(CN)6] и [Co(CN)6] ∙ [Cr(NH3)6].
 2014-02-09
2014-02-09 4031
4031