2.1. Энергия в химическом производстве. Тепловой эффект реакции в технологических расчетах. Направленность реакции в технологических расчетах
Изменение химического состава реагирующей смеси приводит к изменению ее теплосодержания ∆ НТ которое можно рассчитать через энтальпии образования компонентов (∆ НТ )обр:
∆ НТ = Σvi(∆ НТ )обр.i
Если энтальпия образования продуктов меньше, чем энтальпия образования исходных веществ, (∆ НТ < 0), то выделяется теплота Qр = -∆ НТ, называемая теплотой реакции. Если при химическом превращении теплосодержание смеси увеличивается (∆ НТ > 0), то происходит поглощение теплоты.
В зависимости от знака ∆ Н (или Qр) реакции бывают экзотермические (∆ Н < 0, Qр > 0) и эндотермические (∆ Н >0, Qр < 0).
Тепловой эффект реакции входит в запись термохимического уравнения, представляющего собой стехиометрическое уравнение с указанием его теплового результата
VАА + vВВ + … = vRR + vSS + … + Qр.
Значение Qр в уравнении зависит от записи химического уравнения. Например, тепловой эффект реакции, записанной следующим образом: N2 + 3Н2 = 2NН3 в два раза больше, нежели для той же реакции, записанной по-другому: 0,5N2 + 1,5Н2 = NН3, поэтому в справочной литературе Qр приводят прямо в уравнениях, как это сделано в, или указывают изменение энтальпии, соответствующее превращению 1 моля вещества.
Тепловой эффект реакции в технологических расчетах
Знание теплового эффекта реакции необходимо для определения тепловых явлений в технологических процессах. Количество выделившейся (или поглощенной) теплоты qр зависит от количества превращенного вещества ∆N. Если Qр представлена в записи уравнения (3.28), то
qр = Qр ∆NА/vА
В зависимости от знака Qр (экзо- или эндотермическая реакция), теплота в ходе протекания процесса будет выделяться или поглощаться.
Возможность химического превращения
Химический процесс принципиально осуществим, если реакция протекает с уменьшением химического потенциала, называемого также изобарным потенциалом, или энергией Гиббса, т.е. возможность протекания реакции определяется из следующих условий:
при ∆GТ,Р < 0 протекание реакции возможно;
при ∆GТ,Р < 0 протекание реакции невозможно;
при ∆GТ,Р = 0 реакционная система находится
в термодинамическом равновесии,
где ∆GТ,Р - изменение энергии Гиббса при превращении исходных веществ в продукты при температуре Т и давлении Р.
Изменение энергии Гиббса реакции можно рассчитать по уравнению
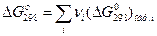
Значения стандартной энергии Гиббса 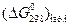 образования веществ при стандартных температуре 298 К и давлении Р = 1 атм приведены в справочной литературе по термодинамике и означают изменение энергии Гиббса при превращении такого количества вещества, находящегося в стандартном состоянии, которое записано в стехиометрическом уравнении. Пример: имеется бесконечно большое количество смеси, содержащей Н2, N2 и NН3, при температуре Т = 298 К и давлении РН2 = РN2 = РNН3 = 1 атм. Если в этой смеси превратиться 1 моль N2 и 3 моля Н2 (на состав бесконечно большого количества смеси это не повлияет), то изменение энергии Гиббса будет равно величине, рассчитанной по формуле.
образования веществ при стандартных температуре 298 К и давлении Р = 1 атм приведены в справочной литературе по термодинамике и означают изменение энергии Гиббса при превращении такого количества вещества, находящегося в стандартном состоянии, которое записано в стехиометрическом уравнении. Пример: имеется бесконечно большое количество смеси, содержащей Н2, N2 и NН3, при температуре Т = 298 К и давлении РН2 = РN2 = РNН3 = 1 атм. Если в этой смеси превратиться 1 моль N2 и 3 моля Н2 (на состав бесконечно большого количества смеси это не повлияет), то изменение энергии Гиббса будет равно величине, рассчитанной по формуле.
Для расчета в условиях, отличающихся от стандартных, используют зависимость энергии Гиббса от температуры
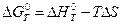
где 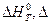 S изменение энтальпии и энтропии при стандартном давлении, которые можно рассчитать по формулам, аналогичным.
S изменение энтальпии и энтропии при стандартном давлении, которые можно рассчитать по формулам, аналогичным.
Зависимость энергии Гиббса от состава реакционной смеси отражает уравнение Вант-Гоффа:

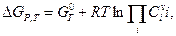
где R — универсальная газовая постоянная, равная 8,314 Дж/моль∙К;
П - знак произведения; Сi- концентрации компонентов; vi - стехиометрические коэффициенты уравнения реакции в алгебраической форме.
Направленность реакции в технологических расчетах
Использование условий позволяет определить возможность получения желаемого продукта — с этого начинают разработку нового способа производства. Другой вариант применения заключается в поиске возможностей, предотвращающих протекание нежелательных реакций.
Продемонстрируем это на следующем примере. При конверсии метана водяным паром возможно образование сажи. Одна из вероятных реакций:
СО + Н2 = С + Н2О;
Из справочных данных и формул для этой реакции получено
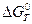 = 132 + 0,133/Т (кДж/моль).
= 132 + 0,133/Т (кДж/моль).
Конверсия метана в промышленном реакторе протекает вблизи равновесия. Соответствующее содержание СО, Н2 и Н2О, ответственных за образование сажи (углерода), для исходной смеси с стехиометрическим соотношением пар: метан = 2:1 при температуре 873 К и давлении 0,1 МПа следующее: ССО = 0,071, СН2 = 0,53, СН2О = 0,24.
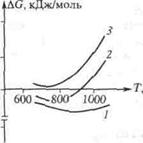 |
Рис. Зависимость энергии Гиббса
∆G от температуры Т для реакции
образования углерода в реакторе
конверсии метана при начальном
соотношении пар: газ = 1:1 (1);
2:1 (2); 4:1 (3)
Такие данные можно получить и для других температур и соотношения исходного состава.
Далее для этих температур и составов смеси по формуле (3.32) рассчитывают ∆GР,Т по реакции. Результаты представлены на рис. При исходном соотношении пар: газ = 1: 1 во всем температурном интервале ∆GР,Т < 0, и потому возможно выделение сажи. При соотношении пар: газ = 2:1 при температурах ниже 900 К, т.е. в какой-то части реактора, также возможно сажеобразование. И только при четырехкратном избытке водяного пара выделение сажи становится невозможным (∆GР,Т > 0 во воем интервале температур).
Примечание. Процесс сажеобразования более сложный, чем описано выше, и потому приведенные результаты показывают качественную картину влияния исходного состава смеси на возможность выделения углерода в конверторе метана.
Итак, термодинамическая возможность является необходимым условием протекания реакции, однако осуществление превращения зависит от кинетики процесса.
 2014-02-12
2014-02-12 1481
1481