Производство фосфорной кислоты. Физико-химические основы процесса. Технологическая схема
Фосфорная кислота H3PO4 является важнейшим промежуточным продуктом в производстве концентрированных фосфоросодержащих удобрений. Кроме того, фосфорная кислота используется в производстве различных технических солей, фосфорорганических соединений, в том числе инсектицидов, полупроводников, ионообменных смол, а также для создания защитных покрытий на металлах. Очищенная или так называемая пищевая фосфорная кислота используется в пищевой промышленности, для приготовления кормовых концентратов и фармацевтических препаратов.
Сырьё для производства фосфорной кислоты – см. сырьевая основа химической промышленности (лекция 1).
Фосфор извлекают из фосфатных руд их разложением. В настоящее время наибольшее распространение получило кислотное разложение руд, содержащих более 25 % Р2О5. Фосфорная кислота образуется непосредственно при растворении руды, т.е. прямым извлечением соединений фосфора экстракцией. Отсюда название продукта - экстракционная фосфорная кислота (ЭФК). Из более бедных руд получают термическую фосфорную кислоту. Процесс основан на восстановлении фосфора из природных фосфатов коксом при высоких температурах и дальнейшем получении Н3РО4 из фосфора.
Функциональная схема производства ЭФК.
Сложность состава исходного сырья, которое не может быть унифицировано, приводит к существованию ряда вариантов технологических схем его переработки. Одним из хорошо исследованных является сернокислотное разложение апатитового концентрата, получаемого обогащением хибинской апатито-нефелиновой руды и содержащего около 39% Р2О5. Его разложение – гетерогенная реакция “жидкость – твердое тело”.
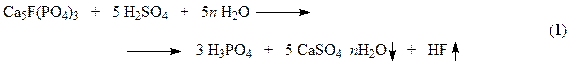
Выделение примесей облегчается переходом их в другую фазу. Кальциевая составляющая выпадает в осадок в виде гипса (CaSO4), вторая уходит в газовую фазу в виде фтороводорода HF. Функциональная схема производства ЭФК (рис. 1) включает разложение измельченного сырья в реакторе (экстракторе), фильтрацию твердого осадка, упаривание фосфорной кислоты до товарной концентрации и очистку отходящих газов. Твердый отход получил название “фосфогипс”. Образующийся фтороводород взаимодействует с пустой породой сырья
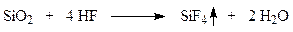
Поэтому при промывке отходящих газов водой оба летучих продукта улавливаются в виде кремнефтористоводородной кислоты H2SiF4.
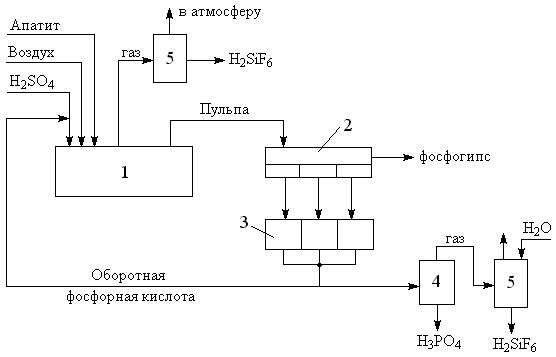
Рисунок. 1. Функциональная схема производства экстракционной фосфорной кислоты.
1 – реактор разложения апатита (экстрактор); 2 – вакуум фильтр; 3 – сборник фильтратов;
4 – колона выпарки фосфорной кислоты; 5 – система очистки газов.
Сернокислотное разложение апатита.
На скорость превращения апатита по реакции (1) влияет отвод продуктов реакции – ионов Са2+ и 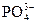 от поверхности частиц в раствор, и чем меньше концентрация Са2+ в растворе, тем скорость растворения будет больше.
от поверхности частиц в раствор, и чем меньше концентрация Са2+ в растворе, тем скорость растворения будет больше.
Одновременно с растворением апатита происходит образование твердого CaSO4, который плохо растворим. Связывание Са2+ в CaSO4 должно увеличивать скорость растворения апатита. Казалось бы, увеличение концентрации серной кислоты, т.е. ионов 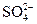 - фактор благоприятный. Но
- фактор благоприятный. Но 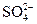 вызывают не только осаждение Са2+ в виде отдельной фазы в растворе, но и на поверхности частиц апатита. Образующаяся корка CaSO4 сначала замедляет растворение, а затем блокирует поверхность, и растворение практически прекращается. Поэтому есть некоторая оптимальная концентрация CaSO4, при которой степень извлечения фосфора из сырья будет максимальной. Таким образом, к концентрации Н2SO4 в реакторе предъявляются жесткие требования: строгое поддержание этой концентрации на оптимальном уровне во всем объеме реакционной зоны.
вызывают не только осаждение Са2+ в виде отдельной фазы в растворе, но и на поверхности частиц апатита. Образующаяся корка CaSO4 сначала замедляет растворение, а затем блокирует поверхность, и растворение практически прекращается. Поэтому есть некоторая оптимальная концентрация CaSO4, при которой степень извлечения фосфора из сырья будет максимальной. Таким образом, к концентрации Н2SO4 в реакторе предъявляются жесткие требования: строгое поддержание этой концентрации на оптимальном уровне во всем объеме реакционной зоны.
Реакционный узел представляет собой последовательность секций с интенсивным перемешиванием реагентов в каждой из них и перетоком между ними для организации движения реакционной массы по каскаду. Перемешивание должно предотвратить расслоение на твердую и жидкую фазы. В первых секциях происходит в основном растворение апатита. Остальные секции работают как дозреватели, в них формируются кристаллы CaSO4. Между последней и первой секциями организован интенсивный рецикл (при кратности циркуляции 20 и более).
Чтобы создать благоприятные условия сначала для растворения, когда необходимо иметь балансовую концентрацию 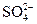 , а затем для формирования кристаллов при небольшом избытке
, а затем для формирования кристаллов при небольшом избытке 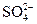 организуют распределенную подачу серной кислоты в одну из первых и в одну из последних секций каскада. Степень разложения апатита достигает 97 % и выше, образуются крупные кристаллы, облегчающие их отделение фильтрацией.
организуют распределенную подачу серной кислоты в одну из первых и в одну из последних секций каскада. Степень разложения апатита достигает 97 % и выше, образуются крупные кристаллы, облегчающие их отделение фильтрацией.
Образование продукционной фосфорной кислоты включает в себя отделение осадка CaSO4 (фосфогипса) и концентрирование кислоты. В зависимости от условий разложения образуются кристаллы CaSO4×2Н2О (дигидрат) или CaSO4×0,5Н2О (полугидрат). В дигидратном процессе температура 343-353 К и концентрация фосфорной кислоты 25-35 %. В полугидратном процессе эти показатели составляют 358-378 К и 35 мас. %. Фосфогипс отделяют на вакуум-фильтре. Фильтрат направляют на выпаривание, где концентрация кислоты увеличивается до 52-54 %. Это и есть продукционная кислота. При выпаривании из кислоты удаляется 80-90 % фтора в виде HF. Отходящие из реактора и из узла выпаривания фторсодержащие газы в системах очистки поглощаются с образованием кремнефтористоводородной кислоты.
На одну тонну продукта образуется более 2,5 т трудно перерабатываемого CaSO4. C ним теряется серная кислота, ее эффективная промышленная регенерация из фосфогипса до сих пор не разработана. Фосфогипс используется для производства гипсовых вяжущих добавок к цементу, строительных изделий, в сельском хозяйстве для гипсования солончаковых почв. Большая часть фосфогипса складируется в отвалы.
Экстракционная кислота используется для получения фосфорных удобрений. Для других целей используется концентрированная фосфорная кислота, которую получают электротермическим методом. Он основан на восстановлении фосфора из фосфатов в электродуговых печах с последующим окислением элементарного парообразного фосфора (Р4) до его оксида
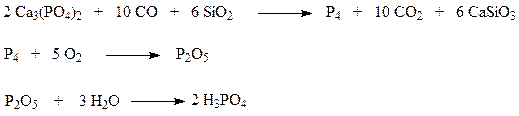
7.3.3. Фосфорные удобрения. Физико-химические основы процессов их производства. Типы реакционных узлов.
Существует ряд методов переработки природных фосфатов в удобрения: механические, термические и методы кислотного разложения.
Одним из методов механической обработки является измельчение фосфатов. Полученная фосфористая мука при использовании в кислых почвах медленно растворяется в почвенных водах и таким образом становится долговременно действующим удобрением.
Фосфорные удобрения могут быть получены термическим разложением фосфатов при температурах 1200 – 1800°С. Так получают термофосфаты, обесфторенные фосфаты, плавленые магниевые и термощелочные фосфаты.
Основным методом получения фосфорных удобрений является химическое разложение фосфатного сырья. Так, в результате сернокислотной обработки получают простой суперфосфат и фосфорную кислоту, которую в свою очередь, перерабатывают в двойной суперфосфат, преципитат и сложные удобрения.
Сущность производства простого суперфосфата состоит в превращении природного фторапатита, нерастворимого в воде и почвенных растворах, в растворимые соединения, преимущественно в монокальцийфосфат (Ca(H2PO4)2)
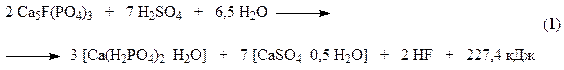
В этом процессе разложение протекает в две стадии. На первой стадии около 70% апатита реагирует с серной кислотой. При этом образуется фосфорная кислота и полугидрат сульфата кальция (уравнение (1)). Эта стадия характеризуется образованием поверхностных пленок CaSO4 на зернах фосфата. Структура образующейся корки обусловлена скоростью кристаллизации твердой фазы, зависящей главным образом от пресыщения раствора сульфатом кальция, которое определяется в свою очередь концентрацией серной кислоты, температурой и другими факторами. Поэтому необходима оптимальная концентрация серной кислоты, сочетающая достаточную скорость растворения апатита с образованием рыхлой пленки, более проницаемой для диффузии серной кислоты к поверхности фосфата. Первая стадия заканчивается через 20 – 40 минут после смешения фосфата с серной кислотой. После полного исчезновения серной кислоты начинается вторая стадия разложения, в которой оставшийся апатит (~ 30%) разлагается фосфорной кислотой

Образующийся монокальцийфосфат в отличие от сульфата кальция не сразу выпадает в осадок. Он постепенно насыщает раствор фосфорной кислоты, после чего начинает выкристаллизовываться в виде Ca(H2PO4)2×H2O и протекает значительно медленнее, чем реакция (1), что объясняется низкой активностью фосфорной кислоты и кристаллизацией твердых фаз. Она начинается в суперфосфатных камерах и длится в течение 5 – 20 суток хранения суперфосфата на складе.
Для получения твердого продукта более высокого качества суперфосфат перед дозреванием подвергают нейтрализации твердыми добавками (известняком, фосфоритной мукой и т.п.) и гранулируют.
 2014-02-12
2014-02-12 3824
3824








