Классификация минеральных удобрений.
Производство минеральных удобрений. Классификация минеральных удобрений
Получение азотной кислоты. Физико-химические основы химических стадий процесса, обоснование выбора параметров и типа реакторов. Технологическая схема процесса.
Проблема фиксации атмосферного азота. Синтез аммиака, Физико-химические основы производства и обоснование выбора параметров и типа реакционного узла. Технологическая схема процесса.
Важнейшие промышленные химические производства
Анализ важнейших химических производств, обоснование выбора условий и типов реакционных узлов в них построены на основе положений теории химических процессов и теории реакторов. По характеру образующихся продуктов рассматриваемые производства подразделены на две группы: неорганические и органические производства, причем объектами изучения являются многотоннажные производства.
Под связанным азотом понимают азот, находящийся в виде соединений с другими элементами – аммиака, азотной кислоты, карбамида, аминов, аминокислот, белков и т.д.
|
|
|
Азот является одним из 4-х элементов, без которых невозможно существование живой материи. Вовлечение азота в геобиохимические циклы осуществляется в природе путем его фиксации из атмосферы некоторыми почвенными микроорганизмами. Тем не мене количество атмосферного азота, фиксируемого этими микроорганизмами, не соответствуют потребностям современной цивилизации. В этой связи перевод атмосферного азота в его соединения в промышленных масштабах является глобальной практической задачей, решение которой нацелено на производство азотных удобрений, восполняющих дефицит связанного азота в почве.
В настоящее время доминирующим методом фиксации атмосферного азота является процесс соединения азота с водородом с получением аммиака.
Синтез аммиака
Синтез аммиака протекает в соответствии со стехиометрическим уравнением
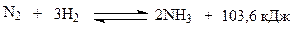 (1)
(1)
Эта реакция обратимая, экзотермическая и сопровождается уменьшением объема. Реакция протекает на катализаторе – пористом железе с добавлением стабилизирующих и промотирующих добавок (Al2O3, K2O, CaO, SiO2 и др.). Он активен и термически устойчив в области температур 650 – 830 К. Соединения серы отравляют катализатор необратимо, а кислород и некоторые его соединения, особенно СО – обратимо, но очень быстро и даже в ничтожно малых концентрациях.
Температура является фактором скорости процесса, однако с ростом температуры равновесие реакции смещается в сторону реагентов. Это обусловливает наличие оптимальной температуры процесса, обеспечивающей максимальную производительность. На практике диапазон оптимальных температур составляет 400-500°С в зависимости от совокупности других параметров.
|
|
|
Давление является одновременно и фактором скорости и фактором смещения равновесия в сторону продуктов реакции. Особенно важна последняя функция давления, т.к. благодаря повышению давления компенсируется негативное действие температуры как фактора смещения равновесия в сторону исходных реагентов. Высокое давление также благоприятствует конденсации аммиака на последующих стадиях. Сверху давление ограничивается увеличением расходов на компримирование и ускорением износа оборудования. Учет влияния всех противоборствующих факторов обусловливает выбор оптимального значения давления. На практике работают при давлениях 30 – 32 МПа.
Соотношение реагентов выбирают исходя из требований стехиометрии и максимальной производительности, которая как раз соответствует стехиометрическому соотношению.
Объемная скорость является фактором увеличения производительности реактора, т.к. величина 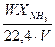 , определяющая производительность, возрастает – снижение конверсии исходной смеси в аммиак перекрывается ростом объемной скорости W. Поскольку с ростом объемной скорости газового потока возрастает объем непрореагировавших газов, которые необходимо возвращать в цикл, то это приводит к увеличению энергозатрат на транспортировку газов, их нагревание, охлаждение, увеличение размеров трубопроводов и реакционной аппаратуры. Другим серьезным препятствием к увеличению объемной скорости является нарушение автотермичности режима из-за снижения тепловыделений. На практике работают с оптимальными значениями W» 40000 ч-1 которому соответствует степень превращения азота 27 – 28%.
, определяющая производительность, возрастает – снижение конверсии исходной смеси в аммиак перекрывается ростом объемной скорости W. Поскольку с ростом объемной скорости газового потока возрастает объем непрореагировавших газов, которые необходимо возвращать в цикл, то это приводит к увеличению энергозатрат на транспортировку газов, их нагревание, охлаждение, увеличение размеров трубопроводов и реакционной аппаратуры. Другим серьезным препятствием к увеличению объемной скорости является нарушение автотермичности режима из-за снижения тепловыделений. На практике работают с оптимальными значениями W» 40000 ч-1 которому соответствует степень превращения азота 27 – 28%.
Высокие объемные скорости в сочетании с соблюдением оптимального температурного режима, применение азото-водородной смеси высокой степени чистоты и использованием достаточно активных контактных масс должны обеспечить большую производительность цехов синтеза аммиака при высоких экономических показателях процесса.
Сырье для синтеза аммиака.
В качестве исходной смеси в процессе синтеза аммиака используется азото-водородная смесь. Водород получают конверсией метана
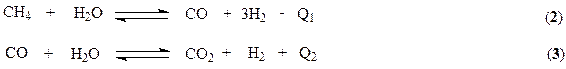
Обе реакции протекают совместно, при этом в целях значительного связывания метана процесс ведут при высоких температурах 1080-1100 К, обеспечивающих практическое смещение равновесия (2) в правую сторону. Процесс ведут в трубчатом реакторе, через межтрубное пространство которого циркулируют горячие топочные газы, образующиеся при горении природного газа в факельных горелках, расположенных в верхней части реактора. С целью форсирования процесса до образования водорода и связывания СО (контактный яд) выходящий из реактора газ поступает на 2-ю ступень конверсии в реактор адиабатического типа. Здесь для поддержания необходимой температуры в реакционной зоне (1230 – 1280 К) в реактор подается воздух. Необходимое тепло аккумулируется за счет частичного сжигания природного газа.
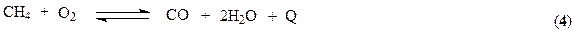
С другой стороны, последняя реакция является источником образования необходимых для реакции (2) и (3) водяных паров. Поскольку вместе с воздухом в реактор подается азот, конвертор 2-ой ступени выполняет одновременно функцию выделения азота из воздуха. Чтобы сформировать стехиометрическую смесь Н2: N2 = 3: 1 воздуха подается столько, сколько требует стехиометрия процесса синтеза аммиака.
Конвертированный газ содержит СО2 (17 – 18 об.%) и СО (0,3 – 0,5 об. %). Первая примесь является балластом для синтеза аммиака. Многократный рецикл азотоводородной смеси содержащий СО2 может привести к прогрессирующему накоплению СО2 в рециркуляте. Это приведет к снижению скорости реакции и смещению равновесия (1) в нежелательную левую сторону. Вторая примесь, СО, является катализаторным ядом. В этой связи, водород, поступающий на синтез, подлежит очистке от СО2 и СО. От диоксида углерода освобождаются абсорбцией 19 – 21% раствором моноэтаноламина (NH2CH2CH2OH).
|
|
|
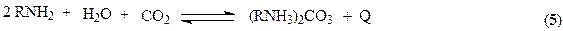
Абсорбцию ведут при низких температурах обеспечивающих смещение равновесия (5) в сторону продукта карбонизации. Полученный абсорбат подвергают десорбции при более высокой температуре смещая равновесие (5) в левую сторону. Образующийся в результате чистый СО2 является товарным продуктом и может использоваться как реагент (синтез мочевины), хладоагент и растворитель для извлечения ценных компонентов из лекарственных трав. Моноэтаноламин после десорбции возвращается на процесс абсорбции.
СО крайне трудно извлечь количественно сорбционными методами. Поэтому очищенный от СО2 водород подвергают метанизации, превращая СО в безвредный для процесса метан. Газ после моноэтаноламинной очистки подогревают и направляют в реактор, содержащий никелевый катализатор. На нем гидрируется СО и остатки СО2.
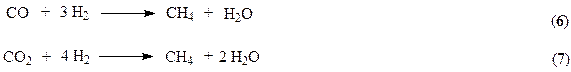
Содержание СО мало и адиабатический разогрев составляет несколько десятков градусов. Это позволяет использовать однослойный реактор. В очищенном газе, поступающем на синтез аммиака содержание СО не должно превышать 20×10-6 об. долей. Суммарное содержание метана в исходном газе составляет около 1 об. %.
Технология процесса.
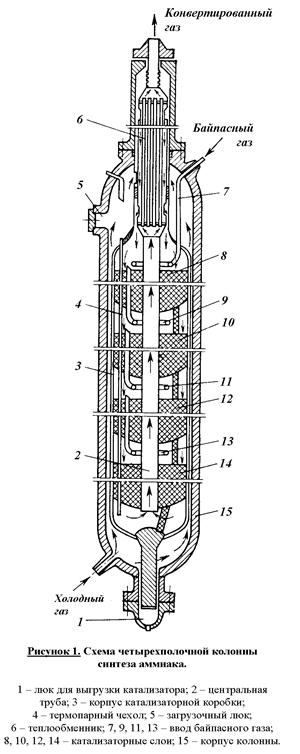
В качестве основного реакционного аппарата синтеза аммиака используется многополочная колонна (рис. 1). Колонна представляет собой цилиндр высотой около 30 м и диаметром примерно 2,5 м, выполненный из специальной стали, способной выдерживать высокие давления, температуры и агрессивное воздействие азота, водорода и аммиака. Холодный газ подается в нижнюю часть колонны и направляется вверх между корпусом колонны (15) и корпусом катализаторной коробки (3). В верхней части реактора холодный газ попадает в межтрубное пространство теплообменника (6), в котором он нагревается до 400°С за счет теплоты выходящего из реактора по трубам теплообменника газа синтеза. Подогретая азотно-водородная смесь проходит последовательно четыре слоя катализатора (8, 10, 12 и 14) и попадает в центральную трубу (2), по которой направляется к теплообменнику (6). При этом газ охлаждается примерно до 330°С.
|
|
|
В связи с тем, что реакция синтеза аммиака экзотермична газ на катализаторных полках сильно нагревается. При этом температура значительно отклоняется от оптимальной. Для регулирования температурного режима предусмотрена подача байпасного потока холодной азото-водородной смеси через патрубки (7, 9, 11 и 13) в каждый слой катализатора.
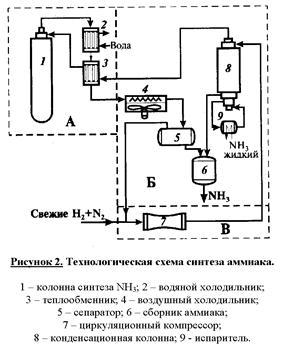
На рисунке 2 приведена сокращенная технологическая схема процесса. Азотно-водородная смесь поступает в реактор 1. Нагретая за счет теплоты экзотермической реакции реакционная смесь, выходящая из колонны синтеза, охлаждается в трех теплообменниках. В первом из них (2) газ охлаждается водой. В теплообменнике (3) нагревается газ, направляемый в реактор. Окончательное охлаждение происходит в воздушном холодильнике (4). В охлажденном газе частично конденсируется аммиак, и его отделяют в сепараторе (5). Жидкий аммиак собирается в сборнике (6) как продукт. Охлаждения до температуры окружающей среды недостаточно для полного выделения аммиака и газ из сеператора направляется в конденсационную колонну (8). В ней газ охлаждается до минус 2¸3°С, так, что в нем остается 3 – 5 об. % аммиака. Охлаждение осуществляют за счет испарения жидкого аммиака в испарители (9). Испаритель может быть совмещен с конденсационной колонной. В ней же жидкий аммиак отделяют от газа и направляют в сборники.
Холодный газ затем подогревают в теплообменнике (3) и возвращают в колонну синтеза (1). Обеспечивают циркуляцию потока компрессором (7). Перед ним в циркуляционный реакционный газ добавляют свежую азото-водородную смесь.
При многократной рециклизации азото-водородной смеси происходит накопление инертов (Ar и CH4) в рециркуляционном газе, поэтому на линии рециркулирующего газа предусмотрена отдувка (вывод) части газа из рецикла. Эти газы можно использовать в качестве топлива или восстановительных агентов для обезвреживания выбросов, содержащих оксиды азота.
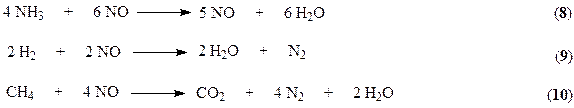
Основные направления в развитии производства аммиака.
1. Кооперирование азотной промышленности с промышленностью основного органического синтеза на базе использования природного газа и газов нефтепереработки в качестве сырья;
2. Укрупнение всего производства в целом, и отдельных его подсистем;
3. Разработка процессов на основе более активных каталитических систем и снижения за счет этого давления в процессе;
4. Применение колонн синтеза с «кипящем слоем» катализатора;
5. Дальнейшее совершенствование систем рационального использования тепла.
Для последней проблемы можно использовать энерготехнологическую систему в производстве аммиака. Сжатие вначале природного газа на стадии конверсии до 4,5 МПа, а затем азото-водородной смеси до 30 – 32 МПа, ее циркуляция в подсистеме синтеза осуществляется помощью мощных турбокомпрессоров. Кроме того, в энергетической системе имеется еще ряд линий. Общее потребление энергии составляет 880 – 900 кВт×ч/т (NH3). Ключевым является компрессор азото-водородной смеси с частотой вращения около 11000 об./мин, потребляющий более половины энергии всего производства аммиака. Применение для привода этого компрессора электродвигателя практически невозможно. Поэтому для этой цели используется энергоноситель – пар с высокими параметрами: давлением до 10 МПа и температурой 720 – 740 К. Для привода других компрессоров используют также паровые турбины на энергоносителях с меньшими параметрами. В производстве аммиака используется высокопотенциальные технологические потоки: конвертированный газ и дымовые газы после конверсии метана. Но их энергии и потенциала недостаточно для образования пара с высокими параметрами. Необходим дополнительный высокотемпературный источник энергии. Им является вспомогательный котел с огневым обогревом, установленный в газоходе после трубчатой печи. Пар, получаемый в котлах, утилизаторах, в линиях технологических потоков и в дополнительном котле, собирается в паросборнике и оттуда распределяется на паровые турбины-приводы компрессоров. Т.о. производство аммиака становится автономным по энергетическому пару, но для его выработки используется свои вторичные энергетические ресурсы, потребляя также дополнительные количества топлива – природный газ.
Чистая азотная кислота – бесцветная жидкость, замерзающая при - 41°С, кипящая при 86°С. Максимальная температура кипения 121,9°С имеет раствор содержащий 68,4% HNO3 и представляющий собой азеотропную смесь. Азотная кислота – очень сильный окислитель. Многие органические вещества при действии азотной кислоты разлагаются, а некоторые способны воспламеняться. Особенно сильна как окислитель разбавленная азотная кислота. Концентрированная азотная кислота пассивирует такие металлы как железо. На этом основано использование стали как конструкционного материала в производстве азотной кислоты.
Промышленность выпускает азотную кислоту двух видов: разбавленную с содержанием 50 – 60 % HNO3 и концентрированную, содержащую 96 – 98 % HNO3. Разбавленная кислота используется в основном для производства азотсодержащих минеральных удобрений. Крепкая азотная кислота применяется для производства взрывчатых веществ, красителей, пластических масс, нитролаков, кинопленки, и других важных продуктов. Азотную кислоту производят из аммиака.
Физико-химические основы процесса.
Производство разбавленной азотной кислоты из аммиака складывается из следующих стадий:
1. контактное окисление аммиака до оксида азота (II);
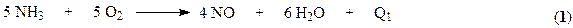
2. доокисление оксида азота (II) до оксида азота (IV);
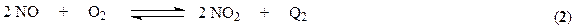
3. поглощение оксида азота (IV) водой с образованием азотной кислоты.
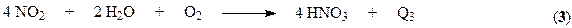
Суммарная реакция образования азотной кислоты выражается уравнением:

Контактное окисление аммиака.
При окислении аммиака кроме основной реакции могут протекать параллельные побочные процессы.
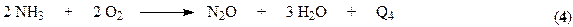
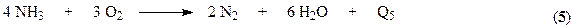
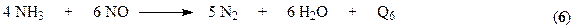
и последовательная реакция

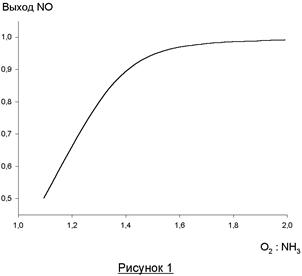
Поэтому одной из проблем увеличения выхода азотной кислоты является создание такого катализатора, который бы действовал избирательно на реакцию (1), мало влияя на побочные реакции. В производстве азотной кислоты в качестве катализаторов используются платиноидные катализаторы (Pt, Pt-Rh и Pt-Pd-Rh-сплавы с содержанием платины 81 – 92%). Основная реакция – очень быстрая и протекает во внешнедиффузионной области, причем процесс лимитируется диффузией кислорода к поверхности катализатора. Это обусловливает повышенную по сравнению кислородом концентрацию аммиака на поверхности катализатора и повышение удельного веса побочных реакций неполного окисления с образованием азота и закиси азота. Поэтому необходим значительный избыток кислорода у поверхности, чтобы вытеснить из нее аммиак. Тогда его окисление будет более глубоким до NO. Влияние соотношения O2: NH3 в потоке на выход NO показано на рисунке 1. Можно видеть, что при соотношении O2: NH3 более 1,8 селективность по NO достигает постоянной максимальной величины, близкой к 100% и далее практически не меняется.
Обоснование роли параметров и их выбор.
Температура оказывает слабо ускоряющее действие на процесс, поскольку реакция лимитируется внешней диффузией. В то же время выход NO изменяется с ростом температуры по экстремальному закону с максимумом в области 900 – 920°С в связи с прогрессированием в этой области реакции (5), а также термической диссоциацией аммиака

и других побочных реакций. Кроме того с ростом температуры возрастает унос катализатора в виде летучего оксида PtO2. Для улавливания Pt под сетки кладут поглотитель на основе CaO, который улавливает более 50% платины. Учет действия указанных противоположных факторов приводит к выбору оптимальной температуры 830 – 930°С (в зависимости от совокупности других параметров). Следует иметь в виду, что положение оптимума температуры зависит от давления. При повышении давления он смещается в область более высоких температур, хотя само значение максимального выхода снижается из-за увеличения удельного веса реакции (6) с ростом давления.
Давление является фактором ускорения процесса, так как является движущей силой внешней диффузии. Вместе с тем, с ростом давления наблюдается снижение выхода оксида азота (II). Поэтому давление является оптимальной величиной, сочетающей взаимно противоположные требования увеличения производительности и уменьшения габаритов установки и повышение выхода NO. Следует также иметь ввиду, что при повышении давления существенно возрастает унос мельчайших частиц платины с газами, что удорожает товарную кислоту, т.к. платина имеет высокую стоимость, а процесс ее улавливания из нитрозных газов после контактного аппарата весьма сложен и не обеспечивает полноту компенсации потерь. На современных установках большой мощности оптимум давления составляет 0,4 – 0,7 МПа.
Состав газовой смеси. При выборе соотношения O2: NH3 руководствуются зависимостью выхода NO от этого соотношения (рисунок 1), связанной с лимитированием процесса диффузией кислорода к поверхности катализатора. Оптимальными значениями O2: NH3 является величина 1,8 – 2,0, что соответствует содержанию аммиака в аммиачно-воздушной смеси 9,5 – 10,5 (об. %). Следует учитывать, что при обычной температуре смесь аммиака с воздухом взрывается в интервале 16 – 27 (об. %), а при увеличении температуры и давления предел взрываемости расширяется.
Время контакта. Высокая селективность катализаторов позволяет в условиях оптимальных давлений, температур и соотношения O2: NH3 достигать 97 – 98% выхода NO при практически полной конверсии аммиака. Поскольку NO при увеличении времени контактирования может далее разлагаться на элементарные N2 и О2, то за время контакта выбирается то минимальное время, при котором достигается практически полная конверсия и которое обеспечивает минимальный объем реактора в условиях практически полного превращения NH3. Это время составляет (1 – 2)×10-1 с.
Окисление оксида азота (II) до диоксида.
Нитрозные газы, полученные при окислении аммиака содержат NO и другие оксиды азота, кислород, азот и пары воды. Для получения азотной кислоты оксид азота (II) окисляют до диоксида.
Процесс окисления NO кислородом воздуха описывается уравнением
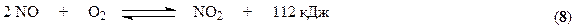
В соответствии с принципом Ле Шателье равновесие этой реакции сдвигается вправо при повышении давления и снижении температуры. Практически равновесие образования диоксида азота при 100°С почти полностью смещено вправо. Константа скорости процесса также увеличивается с понижением температуры. Такое аномальное поведение системы связано с тримолекулярным характером процесса (см. раздел «Химическая кинетика» курса «Физическая химия»). В связи с требованиями смещения равновесия и ускорения процесса температуру необходимо понижать. Однако имеется нижний предел температуры, определяемый прогрессивным возрастанием энергетических затрат, связанных с использованием хладагентов. Вместе с тем понижение температуры обусловливает частичное превращение NO2 в димер
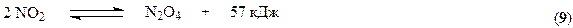
На практике процесс осуществляется при температуре 10 – 50°С.
Давление является фактором ускорения основной реакции и фактором смещения ее равновесия в сторону целевого продукта. Однако одновременно рост давления обусловливает смещение равновесия димеризации в правую сторону. Чрезмерное повышение давления нецелесообразно, так как приводит к росту энергетических затрат на компримирование, а также образованию и выпадению в конденсат значительных количеств N2O4 и HNO3. На практике работают при давлениях 0,40 – 0,45 МПа. Выходящие после реакции контактные газы содержат NO2, N2O4, O2, N2O, NO, N2O3, пары воды.
Время контакта и степень превращения. Реакция окисления протекает самопроизвольно без каких-либо внешних ускорителей. В то же время общий третий порядок реакции обусловливает резкое снижение скорости с увеличением степени конверсии. Поэтому в качестве реактора окисления используют полый цилиндрический аппарат, работающий в режиме вытеснения. При этом резкое снижение скорости с ростом степени превращения реагентов не позволяет осуществить процесс до их полного превращения. Поэтому его проводят до оптимальной степени превращения 92%. Этой величине соответствуют времена контакта порядка нескольких секунд.
Соотношение реагентов необходимо поддерживать в соответствии с требованиями стехиометрии, т.е. 2: 1. При этом достигается максимальная производительность процесса.
Абсорбция диоксида азота.
Все оксиды азота, за исключением NO взаимодействуют с водой с образованием азотной кислоты. Поглощение оксидов азота с водой протекает через две макростадии – физическое растворение этих газов в воде и последующее их химическое взаимодействие с водой с образованием азотной и азотистой кислот. Азотистая кислота является малоустойчивым соединением и распадается на азотную кислоту, оксид азота (II) и воду.
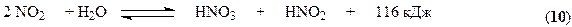
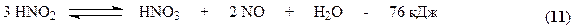
Суммарно взаимодействие NO2 с водой можно представить уравнением
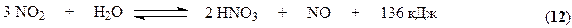
Образующийся NO снова окисляется до NO2

Из двух макростадий – физическое растворение и химическая реакция вторая протекает значительно быстрее и ее скорость определяется скоростью массопереноса газовой фазы в жидкую. Разложение азотистой кислоты происходит сравнительно медленно. Образующийся NO частично окисляется в растворе кислородом, но его большая часть взаимодействует с кислородом уже в газовой фазе по реакции (13). Одновременно с абсорбцией и протеканием химических реакций в растворе в газовой фазе так же частично протекают те же реакции, приводящие к образованию азотной кислоты. При взаимодействии паров воды и NO2 в газовой фазе происходит образование кислотного тумана.
Степень поглощения диоксида азота водными растворами азотной кислоты определяется такими факторами как температура, давление, концентрация кислоты. При понижении температуры и концентрации кислоты и повышении давления степень превращения диоксида азота растет. При концентрации азотной кислоты выше 65% поглощение практически прекращается.
Следует также отметить, что степень окисления NO зависит от свободного объема, а количество поглощаемых оксидов азота – от поверхности контакта фаз. Поэтому одно из основных требований, предъявляемых к абсорбционной аппаратуре – создание максимального свободного объема при одновременно сильно развитой поверхности поглощения. Поэтому реактор образования азотной кислоты – абсорбционная колонна с копачковыми или ситчатыми тарелками. Пространство между тарелками работает как газофазный окислитель основного количества выделившегося NO. Барботаж в новом слое жидкости на тарелке обеспечивает интенсивный массообмен с газом, способствуя поглощению компонентов газофазной смеси и тем самым образованию HNO3 и жидкофазному окислению NO. Достаточно большой объем газовой фазы между тарелками позволяет достичь высоких степеней газофазного окисления NO в NO2, можно считать, что в абсорбционной колонне протекает превращение, описываемые следующим брутто-уравнениями:
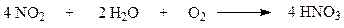
Для отвода избыточного тепла на тарелках установлены плоские змеевидные холодильники с циркулирующей в них водой.
Технология процесса.
Современные установки, работающие под повышенным давлением (от 0,2 до 1 МПа) разработаны по принципу энерготехнологических схем, в которых энергия отходящих газов (связанная с их высокой температурой и давлением) и теплота реакции окисления аммиака, используются для сжатия воздуха и нитрозных газов, а также получения технологического пара. Этими же схемами предусмотрено более полное использование низкопотенциальной энергии. Принципиальная технологическая схема получения разбавленной азотной кислоты под повышенным давлением приведена на рисунке 2
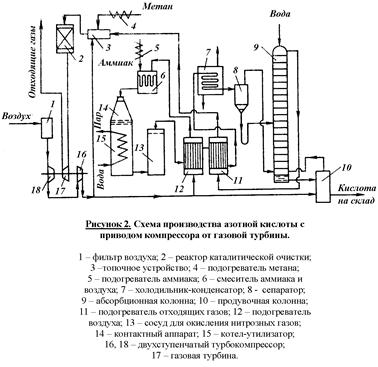
Атмосферный воздух проходит тщательную очистку в двухступенчатом фильтре (1). Очищенный воздух сжимается двухступенчатым воздушным компрессором (16, 18). В первой ступени (18) воздух сжимается до 0,35 МПа, при этом он нагревается до 165 – 175°С за счет адиабатического сжатия. После охлаждения воздух направляется на вторую ступень сжатия (16), где его давление доводят до 0,7 – 0,8 МПа.
Основной поток воздуха после сжатия нагревают в подогревателе (12) до 250 – 270°С теплотой нитрозных газов и подают на смешение с аммиаком в смеситель (6).
Газообразный аммиак, полученный испарением жидкого аммиака, после очистки от влаги, масел и катализаторной пыли через подогреватель (5) при температуре 150°С также направляют в смеситель (6). Смеситель совмещен в одном аппарате с поронитовым фильтром. После очистки аммиачно-воздушную смесь с содержанием аммиака не более 10% подают в контактный аппарат (14) на окисление аммиака. Конверсия аммиака протекает на Pt-Pd-Rh-сетках при 870-900°С причем степень конверсии составляет 97 – 98%. Нитрозные газы при 890 – 910°С поступают в котел-утилизатор (15), расположенный под контактным аппаратом. В котле за счет тепла контактных газов протекает испарение химически очищенной деаэрированной воды, питающей котел-утилизатор. При том получается пар с давлением 1,5 МПа и температурой 230°С, который поступает потребителю.
После котла-утилизатора нитрозные газы поступают в окислитель нитрозных газов (13). Он представляет собой полый аппарат в верхней части которого установлен фильтр из стекловолокна для улавливания платинового катализатора. Частично окисление нитрозных газов происходит уже в котле-утилизаторе (до 40%). В окислителе (13) степень окисления нитрозных газов доводят до 85%. За счет реакции окисления нитрозные газы нагреваются до 300 – 335°С. Эта теплота используется в подогревателе воздуха (12). Охлажденные в теплообменнике (12) нитрозные газы поступают для дальнейшего охлаждения в теплообменник (11), где происходит снижение их температуры до 150°С и нагрев хвостовых газов до 110 – 125°С. Затем нитрозные газы направляют в холодильник-конденсатор (7), охлаждаемый оборотной водой. При этом конденсируются водяные пары и образуется слабая азотная кислота. Нитрозные газы отделяют от сконденсировавшейся азотной кислоты в сепараторе (8), из которого азотную кислоту направляют в абсорбционную колонну (9) на одну из средних тарелок, с соответствующей концентрацией кислоты. Нитрозные газы направляют в нижнюю часть колонны (9). Сверху в нее подают охлажденный конденсат. Образующаяся в верхней части азотная кислота низкой концентрации перетекает на нижние тарелки и по мере их прохождения укрепляется за счет поглощения новых порций нитрозных газов. При выходе из нижней части колонны концентрация кислоты достигает 55 – 58%, причем содержание растворенных в ней оксидов азота достигает ~ 1%. Поэтому кислота направляется в продувочную колонну (10), где подогретым воздухом из нее отдуваются оксиды азота, а отдутая кислота направляется на склад. Воздух после продувочной колонны подается в нижнюю часть абсорбционной колонны (9).
Степень абсорбции оксидов азота достигает 99%. Выходящие из колонны хвостовые газы с содержанием оксидов азота до 0,11% при температуре 35°С проходят подогреватель (11), где нагреваются до 110 – 145°С и поступают в топочное устройство (камера сжигания) (3) установки каталитической очистки. Здесь газы нагреваются до температуры 390 – 450°С за счет горения природного газа, подогреваемого в подогревателе (4), и направляемого в реактор с двухслойным катализатором (2), где первым слоем служит оксид алюминия. Очистку осуществляют при температурах 690 – 700°С. Энергия, вырабатываемая турбиной за счет теплоты хвостовых газов, используется для привода турбокомперессора (18). Затем газы направляют в котел-утилизатор и выбрасывают в атмосферу. Содержание оксидов азота в очищенных выхлопных газах составляет 0,005 – 0,008%, содержание СО2 – 0,23%. Таким образом данный агрегат полностью автономен по энергии.
Минеральные удобрения являются одним из важнейших для хозяйственной деятельности человека видов продукции химической промышленности.
Рост численности населения выдвигает перед всеми странами одну и ту же проблему – умелое управление способностью природы воспроизводить жизненные ресурсы и прежде всего продовольственные. Задача расширенного воспроизводства продуктов питания уже давно решается путем применения в сельском хозяйстве минеральных удобрений.
Минеральные удобрения классифицируют по трем главным признакам - агрохимическому назначению, составу и свойствам.
По агрохимическому назначению удобрения подразделяют на прямые, являющиеся источником питательных элементов для растений, и косвенные, служащие для мобилизации питательных веществ почвы путем улучшения ее физических, химических и биологических свойств. К косвенным удобрениям относятся, например, известковые удобрения, применяемые для нейтрализации кислых почв, структурообразующие удобрения, способствующие агрегированию частиц тяжелых и суглинистых почв и др.
Прямые минеральные удобрения могут содержать один или несколько разных питательных элементов. По количеству питательных элементов удобрения подразделяют на простые (односторонние) и комплексные.
В простые удобрения входит только один из трех главных питательных элементов: азот, фосфор или калий. Соответственно, простые удобрения делят на азотные, фосфорные и калийные.
Комплексные удобрения содержат два или три главных питательных элемента. По числу главных питательных элементов комплексные удобрения подразделяют на двойные (например, типа NP или РК) и тройные (NPK). Последние называют также полными. Удобрения, содержащие значительные количества питательных элементов и мало балластных веществ называют концентрированными.
Комплексные удобрения, кроме того, подразделяют на смешанные и сложные. Смешанными называют механические смеси удобрений, состоящие из разнородных частиц. Если же удобрение представляет собой сложные соединения, являющиеся результатом химического взаимодействия, то они относятся к сложным.
Удобрения, предназначенные для питания растений элементами, стимулирующими их рост и требующиеся в малых количествах, называются микроудобрениями, а содержащиеся в них питательные элементы – микроэлементами. Такие удобрения вносят в почву в очень малых количествах. К ним относятся соли, содержащие бор, марганец, медь, цинк, и др. элементы.
По агрегатному состоянию удобрения подразделяют на твердые и жидкие (например, аммиачная вода, водные растворы и суспензии).
К физическим свойствам минеральных удобрений предъявляется ряд требований. Водорастворимые соли должны быть сыпучими, легко рассеиваться, не быть сильно гигроскопичными, не слеживаться при хранении, должны обладать такими свойствами, чтобы сохраняться в почве в течении некоторого времени, не слишком быстро вымываться дождевой водой и не сдуваться ветром. Этим требованиям в наибольшей степени отвечают крупнокристаллические и гранулированные удобрения. Гранулированные удобрения можно вносить на поле с помощью туковых машин и сеялок в количествах, строго соответствующих агрохимическим требованиям.
Эффективным свойством для уменьшения слеживаемости является обработка поверхности гранул поверхностно-активными веществами. В последние годы стали рассматриваться способы создания вокруг гранул специальных оболочек, которые с одной стороны предохраняют удобрение от слеживания, с другой – позволяют регулировать во времени процесс растворения питательных веществ в почвенных водах, т.е. создавать долговременно действующие удобрения.
Рассмотрим некоторые процессы получения фосфорных, азотных и комплексных удобрений.
Важнейшими видами минеральных удобрений являются азотные удобрения: аммиачная селитра, карбамид, сульфат аммония, водные растворы аммиака и др.
Азотные удобрения отличаются друг от друга по содержанию азота, по форме соединений азота (нитратные, аммонийные, амидные), фазовому состоянию (твердые и жидкие).
 2014-02-12
2014-02-12 3218
3218
