Основная задача химической термодинамики – расчет константы химического равновесия и определение выхода продуктов реакции.
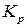 можно рассчитать на основании данных об абсолютных значениях энтропии веществ, участвующих в данных реакциях.
можно рассчитать на основании данных об абсолютных значениях энтропии веществ, участвующих в данных реакциях.
Изменение энергии Гиббса:
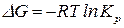 . (119)
. (119)
В соответствии с уравнением Гиббса–Гельмгольца:
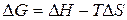 . (84)
. (84)
Тогда
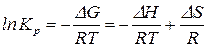 . (131)
. (131)
Подставим значения 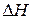 и
и 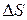
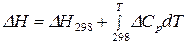 ;
; 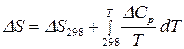 .
.
в уравнение (131), получим:
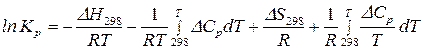 (132)
(132)
или
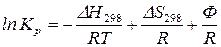 , (133)
, (133)
где 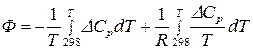 .
.
Точное решение уравнения (132) возможно, если известна зависимость 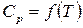 каждого реагента. Однако, точное решение не всегда целесообразно. Поскольку
каждого реагента. Однако, точное решение не всегда целесообразно. Поскольку 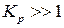 и соответствующие очень большие отрицательные или положительные значения
и соответствующие очень большие отрицательные или положительные значения 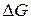 указывают на сильный сдвиг равновесия в сторону продуктов реакции или исходных веществ. Этих данных вполне достаточно, чтобы судить о возможности и полноте протекания реакции в указанных условиях. В связи с этим существует целый ряд методов приближенного расчета константы равновесия по уравнению (133).
указывают на сильный сдвиг равновесия в сторону продуктов реакции или исходных веществ. Этих данных вполне достаточно, чтобы судить о возможности и полноте протекания реакции в указанных условиях. В связи с этим существует целый ряд методов приближенного расчета константы равновесия по уравнению (133).
Для приближенного расчета константы химического равновесия удобно использовать метод Темкина-Шварцмана.
В уравнении (133) функция 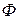 находится как
находится как
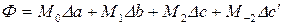 ,
,
где 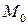 ,
, 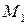 ,
, 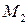 ,
, 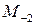 – функции температуры, значения которых приведены в справочной литературе.
– функции температуры, значения которых приведены в справочной литературе.
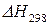 и
и 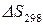 – определяют, пользуясь 2 следствием из закона Гесса.
– определяют, пользуясь 2 следствием из закона Гесса.
 2014-02-12
2014-02-12 415
415








