РАВНОВЕСИЯ (УРАВНЕНИЕ ПЛАНКА)
ВЛИЯНИЕ ДАВЛЕНИЯ НА КОНСТАНТУ ХИМИЧЕСКОГО
Для установления влияние давления на реакции, протекающие с участием газообразных веществ, воспользуемся константой равновесия, выраженной через равновесные мольные доли, Kх= f (T, p).
Выражение (114), записанное в виде 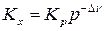 , логарифмируют и полученное выражение с учетом того, что Kр не является функцией давления, дифференцируют по давлению при постоянной температуре
, логарифмируют и полученное выражение с учетом того, что Kр не является функцией давления, дифференцируют по давлению при постоянной температуре
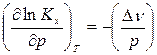 . (129)
. (129)
Считая газы, участвующие в реакции, идеальными, можно из уравнения Менделеева-Клапейрона выразить изменение числа моль газообразных веществ в реакции 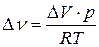 и подставить в уравнение (128). Тогда
и подставить в уравнение (128). Тогда
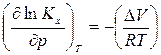 . (130)
. (130)
Полученные уравнения (129) и (130) описывают влияние давления на химическое равновесие в идеальной газовой реакции и называют уравнением Планка. Проведем анализ данного уравнения:
1) если реакция протекает с увеличением объема (количества вещества), то при повышении давления 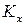 уменьшается. Это означает, что для реакций типа А + B = 3 C с ростом давления равновесие смещается в сторону исходных веществ;
уменьшается. Это означает, что для реакций типа А + B = 3 C с ростом давления равновесие смещается в сторону исходных веществ;
2) если реакция протекает с уменьшением объема (количества вещества), то при повышении давления 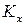 увеличивается. Для реакций типа А + 2 B = C с ростом давления равновесие смещается в сторону продуктов реакции;
увеличивается. Для реакций типа А + 2 B = C с ростом давления равновесие смещается в сторону продуктов реакции;
3) если реакция протекает без изменения объема (количества вещества), то при повышении давления 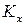 не изменяется. Это означает, что для реакций типа А + B = 2 C с ростом давления равновесие не изменяется.
не изменяется. Это означает, что для реакций типа А + B = 2 C с ростом давления равновесие не изменяется.
Влияние давления на химическое равновесие в растворе незначительно, так как объем раствора практически не изменяется.
 2014-02-12
2014-02-12 475
475








