ХИМИЧЕСКОГО РАВНОВЕСИЯ (уравнения изобары
ВЛИЯНИЕ ТЕМПЕРАТУРЫ НА КОНСТАНТУ
В качественной форме смещение равновесия описывается принципом Ле-Шателье: если на систему, находящуюся в устойчивом равновесии оказать внешнее воздействие, то равновесие сместится в направлении процесса, течение которого ослабляет влияние произведенного воздействия.
Пусть химическая реакция (106) протекает в идеальной газовой фазе. Тогда при 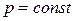 стандартная максимальная работа химической реакции:
стандартная максимальная работа химической реакции:
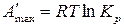 . (119)
. (119)
Максимальная работа процесса в соответствии с уравнением Гиббса–Гельмгольца:
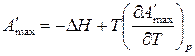 . (85)
. (85)
Продифференцируем уравнение (119) по температуре:
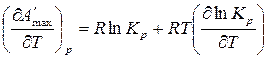 . (123)
. (123)
Подставим в уравнение (85) вместо 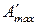 и
и 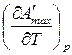 их значения из (119) и (123), получим:
их значения из (119) и (123), получим:
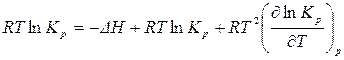 .
.
Преобразуем: 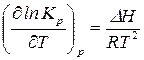 . (124)
. (124)
Аналогично при 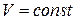 :
:
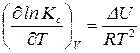 . (125)
. (125)
Уравнения (124) и (125) называют уравнениями изобары и изохоры химической реакции. Они характеризуют влияние температуры на константу химического равновесия.
Уравнения изобары и изохоры позволяют спрогнозировать изменение константы химического равновесия при изменении температуры. Знак производной, стоящей в левой части уравнений, а, следовательно, и направление изменения 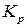 при изменении
при изменении 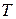 определяется знаком теплового эффекта химической реакции. Если:
определяется знаком теплового эффекта химической реакции. Если:
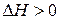 – для эндотермической реакции константа химического равновесия
– для эндотермической реакции константа химического равновесия 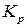 возрастает с увеличением температуры. Химическое равновесие смещается в сторону увеличения выхода продуктов реакции (
возрастает с увеличением температуры. Химическое равновесие смещается в сторону увеличения выхода продуктов реакции (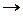 );
);
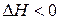 – для экзотермической реакции
– для экзотермической реакции 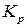 убывает с увеличением температуры. Химическое равновесие смещается в сторону уменьшения выхода продуктов реакции (
убывает с увеличением температуры. Химическое равновесие смещается в сторону уменьшения выхода продуктов реакции (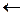 );
);
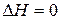 – температура не влияет на
– температура не влияет на 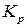 .
.
Разделим переменные в уравнении изобары
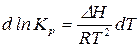 . (126)
. (126)
1. Проинтегрируем в небольшом температурном интервале, считая, что 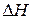 не зависит от температуры:
не зависит от температуры:
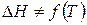
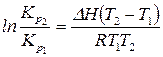 . (127)
. (127)
Применяя уравнение (127), можно рассчитать средний тепловой эффект реакции 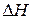 , если известны значения констант равновесия в узком интервале температур или рассчитать
, если известны значения констант равновесия в узком интервале температур или рассчитать 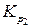 , если известно
, если известно 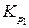 и средняя величина теплового эффекта реакции в интервале температур от
и средняя величина теплового эффекта реакции в интервале температур от 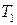 до
до 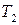 .
.
 2014-02-12
2014-02-12 393
393








