Уравнение состояния однокомпонентной
(УРАВНЕНИЕ кЛАУЗИУСА – КЛАПЕЙРОНА)
Уравнением состояния гетерогенной системы называют уравнение, которое связывает все параметры состояния этой системы.
Рассмотрим закономерности фазовых превращений чистого индивидуального вещества (плавление, испарение, возгонка, …, переход твердого вещества из одной полиморфной модификации в другую).
При равновесии в соответствии с теоремой равновесия Гиббса химический потенциал компонента 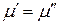 . Так как состав фаз постоянен, то химический потенциал компонента зависит только от внешних параметров
. Так как состав фаз постоянен, то химический потенциал компонента зависит только от внешних параметров 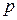 и
и 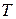 :
:
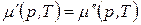 . (146)
. (146)
С учетом уравнений (87) для химического потенциала и (83) для энергии Гиббса:
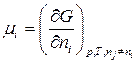 ; (87)
; (87)
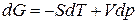 , (83)
, (83)
из уравнения (146), получим
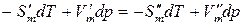 ,
,
где 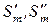 – мольная энтропия компонента в 1-ой и 2-ой фазах соответственно;
– мольная энтропия компонента в 1-ой и 2-ой фазах соответственно;
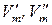 – мольный объем компонента в 1-ой и 2-ой фазах соответственно.
– мольный объем компонента в 1-ой и 2-ой фазах соответственно.
Преобразуем:
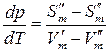 .
.
где 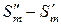 – есть изменение энтропии при переходе 1 моль вещества из фазы ′ в фазу ″, т.е. это мольная энтропия фазового превращения.
– есть изменение энтропии при переходе 1 моль вещества из фазы ′ в фазу ″, т.е. это мольная энтропия фазового превращения.
Тогда
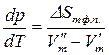 .
.
Изменение энтропии при фазовом превращении определяется
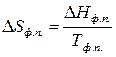 . (58)
. (58)
Следовательно,
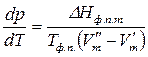 . (147)
. (147)
Выражение (147) – уравнение состояние однокомпонентной двухфазной системы и называется уравнением Клаузиуса – Клапейрона.
Уравнение позволяет рассчитать 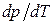 для фазовых переходов. Величины, входящие в уравнение, приводятся в справочной литературе.
для фазовых переходов. Величины, входящие в уравнение, приводятся в справочной литературе.
Применим уравнение (147) для различных процессов.
1. В процессе плавления производная 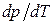 в (147) имеет физический смысл: она показывает, на какую величину нужно изменить давление, чтобы изменить температуру плавления вещества на 1 градус.
в (147) имеет физический смысл: она показывает, на какую величину нужно изменить давление, чтобы изменить температуру плавления вещества на 1 градус.
Так как 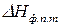 и
и 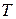 в уравнении (147) положительны, то знак производной определяется знаком
в уравнении (147) положительны, то знак производной определяется знаком 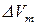 .
.
а) Для большинства веществ плотность 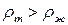 (
(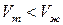 ), тогда,
), тогда, 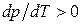 и, как правило, имеет значение 10 – 100
и, как правило, имеет значение 10 – 100 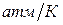 . Следовательно, с повышением давления температура плавления будет увеличиваться.
. Следовательно, с повышением давления температура плавления будет увеличиваться.
Пример: для бензола 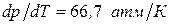 , т.е. для увеличения температуры плавления на 1
, т.е. для увеличения температуры плавления на 1 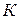 , необходимо увеличить давление на 66,7
, необходимо увеличить давление на 66,7 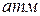 .
.
б) Лишь некоторые вещества расширяются при затвердевании (например, вода, висмут). Если 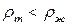 (
(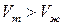 ), то
), то 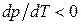 и с повышением давления температура плавления будет снижаться. Для воды
и с повышением давления температура плавления будет снижаться. Для воды 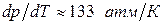 .
.
Как видно, температура плавления является важной физической характеристикой вещества. По 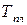 можно идентифицировать соединения.
можно идентифицировать соединения.
2. Для процессов возгонки твердого вещества или испарения жидкости можно допустить, что 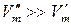 . Тогда уравнение (147) можно записать, пренебрегая объемом жидкости (или твердого вещества)
. Тогда уравнение (147) можно записать, пренебрегая объемом жидкости (или твердого вещества) 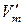 по сравнению с объемом паровой фазы
по сравнению с объемом паровой фазы 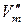 :
:
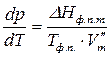 .
.
Если паровую фазу можно считать идеальной, то по уравнению Менделеева – Клапейрона 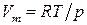 , а уравнение Клаузиуса – Клапейрона запишется:
, а уравнение Клаузиуса – Клапейрона запишется:
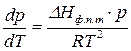 .
.
Или после преобразования:
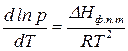 . (148)
. (148)
Разделим переменные в (148)
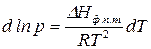 . (149)
. (149)
Для процесса испарения уравнение (149) показывает зависимость давления насыщенного пара от температуры.
2.1 Проинтегрируем (149) в определенных пределах в узком интервале температур, считая 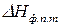 постоянной величиной, т.е. при
постоянной величиной, т.е. при 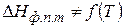 (выбранный интервал должен быть настолько узким, чтобы можно было пренебречь зависимостью
(выбранный интервал должен быть настолько узким, чтобы можно было пренебречь зависимостью 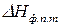 от
от 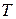 ). В результате получим:
). В результате получим:
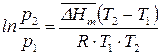 , (150)
, (150)
где 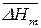 – среднее значение теплоты ф. п. в интервале температур
– среднее значение теплоты ф. п. в интервале температур 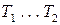 .
.
На основе уравнения (150) можно рассчитать:
1) температуру кипения вещества 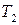 при давлении
при давлении 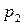 , если известна температура кипения
, если известна температура кипения 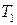 этого вещества при давлении
этого вещества при давлении 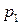 и величина средней мольной теплоты испарения
и величина средней мольной теплоты испарения 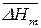 ;
;
2) давление насыщенного пара индивидуального вещества 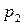 при температуре
при температуре 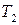 , если известно давление насыщенного пара
, если известно давление насыщенного пара 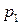 при температуре
при температуре 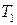 и средняя мольная теплота испарения;
и средняя мольная теплота испарения;
3) среднюю мольную теплоту испарения или возгонки вещества 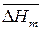 , если известны значения давления насыщенного пара вещества при двух температурах:
, если известны значения давления насыщенного пара вещества при двух температурах:
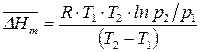 .
.
2.2 а) При интегрировании (149) в широком интервале температур необходимо учитывать зависимость 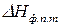 от
от 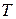 –
– 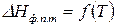 .
.
Эта зависимость выражается законом Кирхгофа в интегральной форме:
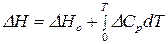 ,
,
где 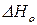 – теплота испарения или возгонки вещества при абсолютном нуле.
– теплота испарения или возгонки вещества при абсолютном нуле.
Так как 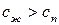 , то
, то 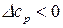 , а
, а 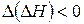 .
.
Подставим выражение для 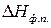 в уравнение Клаузиуса – Клапейрона (149):
в уравнение Клаузиуса – Клапейрона (149):
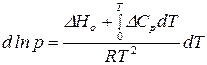 .
.
Проинтегрируем в неопределенных пределах от 0 до 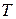 :
:
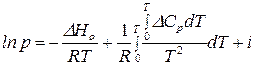 ,
,
где 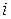 – химическая постоянная вещества (константа интегрирования).
– химическая постоянная вещества (константа интегрирования).
Химическая постоянная –имеет физический смысл теплоты возгонки или испарения при абсолютном ноле температуры. Численное значение химической постоянной может быть рассчитано либо на основе экспериментальных данных, либо методами статистической термодинамики. Величину химической постоянной широко используют при расчете химических равновесий (см. раздел 2.7.).
б) проинтегрируем уравнение (149) в неопределенных пределах, пренебрегая зависимостью 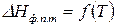 , получим:
, получим:
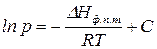 , (151)
, (151)
где 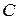 – константа интегрирования.
– константа интегрирования.
Как видно, зависимость 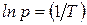 имеет линейный характер, поэтому по тангенсу угла наклона прямой на графике в указанных координатах можно рассчитать теплоту испарения или возгонки.
имеет линейный характер, поэтому по тангенсу угла наклона прямой на графике в указанных координатах можно рассчитать теплоту испарения или возгонки.
Применим уравнение (151) для характеристики процесса кипения различных жидкостей при 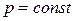 , например, при
, например, при 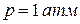 . Тогда
. Тогда
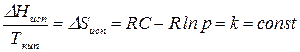 , (152)
, (152)
где 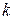 – константа Трутона.
– константа Трутона.
Уравнение (152) выражает правило Трутона: мольная энтропия различных жидкостей при 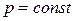 есть величина постоянная.
есть величина постоянная.
Все жидкости, которые подчиняются правилу Трутона, называют нормальными. Для них 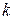 = 21 – 22.
= 21 – 22.
Некоторые жидкости обнаруживают отклонения от свойств нормальных. Их называют аномальными (или ассоциированными). Причина отклонений заключается в способности молекул жидкостей образовывать водородные связи (например, вода, спирты, амины, кислоты и т.д.). Для таких жидкостей мольная энтропия больше константы Трутона, так как при испарении требуется дополнительная энергия для разрушения водородных связей между молекулами в жидком состоянии.
 2014-02-12
2014-02-12 2126
2126








