ЛЕКЦИЯ 14
Пусть имеется раствор слабого электролита, диссоциация которого происходит в соответствии с уравнением:
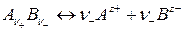 . (171)
. (171)
Если исходная концентрация данного электролита 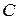 , а степень диссоциации –
, а степень диссоциации – 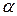 , то при установившемся равновесии:
, то при установившемся равновесии:
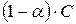 – концентрация недиссоциированных молекул
– концентрация недиссоциированных молекул 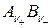 ;
;
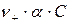 – концентрация катионов
– концентрация катионов 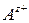 ;
;
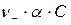 – концентрация анионов
– концентрация анионов 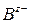 .
.
В соответствии с законом действия масс константа диссоциации реакции (171) равна:
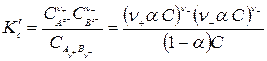 .
.
Преобразуем: 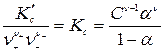 . (180)
. (180)
где 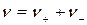 ;
;
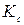 – константа равновесия, которая зависит от температуры и природы растворителя, но не зависит от концентрации электролита.
– константа равновесия, которая зависит от температуры и природы растворителя, но не зависит от концентрации электролита.
Уравнение (180) выражает закон разведения (разбавления) Оствальда: с уменьшением концентрации электролита в растворе (ростом разбавления) степень диссоциации 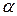 увеличивается.
увеличивается.
Бинарным называют электролит, при диссоциации которого образуются два иона (катион и анион).
Для бинарного 1,1 – электролита закон разведения Оствальда запишется:
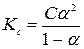 . (181)
. (181)
Зависимость константы диссоциации слабого электролита от температуры выражается уравнением изохоры:
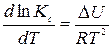 . (125)
. (125)
Поскольку процесс диссоциации эндотермический (теплота диссоциации 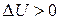 ), то с повышением температуры
), то с повышением температуры 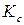 и
и 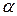 всегда увеличиваются.
всегда увеличиваются.
Закон разведения Оствальда применим только для разбавленных растворов, свойства которых близки к свойствам идеальных растворов. В концентрированных растворах возрастают силы электростатического взаимодействия ионов и возникают значительные отклонения от свойств идеальных растворов. Поэтому для описания равновесий в таких растворах вместо концентраций компонентов необходимо применять активности:
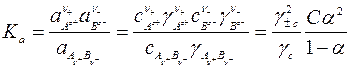 , (182)
, (182)
где 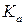 – термодинамическая константа диссоциации зависит от температуры и не зависит от концентрации;
– термодинамическая константа диссоциации зависит от температуры и не зависит от концентрации;
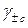 – средний ионный молярный коэффициент активности;
– средний ионный молярный коэффициент активности;
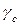 – коэффициент активности недиссоциированных молекул.
– коэффициент активности недиссоциированных молекул.
 2014-02-12
2014-02-12 1054
1054
