Истинная скорость реакции определяется средней скоростью перехода активированных комплексов через вершину барьера. Как показывает статистическая механика, вероятность P(r)1 того, что молекула имеет скорость, лежащую между r b r +dr для одной степени свободы, например для движения в заданном направлении,
P(r)1 = const ∙e-mr2/kT∙ dt, (2)
где m – масса частицы (комплекса). Если предположить для активированного комплекса термически равновесное распределение скоростей, то средняя скорость движения комплекса в одном напрвлении, а именно в направлении прямой реакции, определяется следующим образом:
∞ ∞
r* = ∫ exp(-mr2/kT) ∙ rdr / ∫ exp(-mr2/kT) ∙ rdr (3)
0 -∞
Здесь пределы интегрирования в знаменателе взяты от -∞ до ∞, что учитывает фактическое движение комплексов в обоих направлениях, в то время как в числителе интегрирование производится от 0 до ∞, так как требуется определить скорость только в направлении разложения комплекса. Вычисление средней скорости прохождения через барьер в одном направлении вдоль координаты реакции (3) дает
|
|
|
r* = (kT/2πm*)1/2, (4)
где k – константа Больцмана, Т – абсолютная температура, m* – эффективная масса комплекса для данного направления.
Среднее время прохождения активированного комплекса τ, являющееся
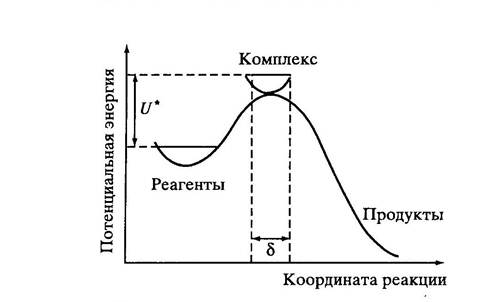
средней продолжительностью его жизни, равняется длине вершины барьера δ (рис. 3), деленной на среднюю скорость r из уравнения (4). Тогда
r = δ/r = δ(2πm*/kT)1/2. (5)
 2014-02-12
2014-02-12 688
688








