Рис. 2. Диаграмма потенциальной энергии вдоль координаты реакции
Рис. 1. Простейшая 2-х мерная поверхность потенциальной энергии для
реакции А + ВС → АВ + С при расположение всех трех атомов на одной прямой
По осям координат – межатомные расстояния rBC и rAB. Кривые 1 – 5 уровни постоянной энергии, штриховая линия – координата реакции, х – седловинная точка.
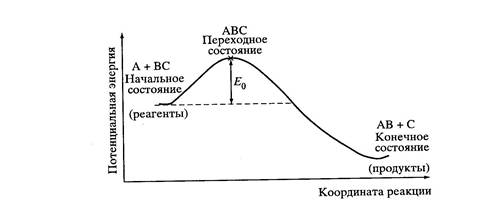
Чаще используют одномерные схемы, представляющие сечение вдоль координаты реакции (рис. 2). На этих схемах состояния А + ВС и АВ + С являются устойчивыми минимумами, а вершине потенциального барьера соответствует седловинная точка, или точка перевала (х). Высота потенциального барьера определяется конфигурацией частиц, величиной энергии, необходимой для преодоления отталкивания, и некоторыми другими факторами. Каждому расстоянию между реагирующими частицами отвечает точка на поверхности потенциальной энергии.
Химическая реакция рассматривается как переход от конфигурации реагентов к конфигурации продуктов через точку АВС. Эту точку (или некий малый отрезок траектории реакции длиною δ) называют активированным комплексом или переходным состоянием.
Разность Ео между энергиями начального состояния и активированного комплекса АВС представляет собой энергию активации элементарной реакции А + ВС. Координата реакции – наиболее выгодный путь протекания реакции, требующий наименьших энергетических затрат.
Начиная с работ Г. Эйринга, существует много приближенных расчетных способов нахождения поверхностей потенциальной энергии для адсорбции и катализа, точные подходы требуют сложных квантово-механических вычислений на практике и в расчетах скоростей адсорбции и катализа почти не применяются.
В основе теории активированного комплекса или теории переходного состояния (она же теория абсолютных скоростей), лежат три предположения:
1. Соблюдается максвелл–больцмановское равновесие между активированным комплексом и реагентами, поэтому их концентрацию можно вычислить с помощью функции распределения Максвелла – Больцмана.
2. Скорость реакции отождествляется со скоростью распада активированного комплекса. Реакция протекает с преодолением самого низкого потенциального барьера в точке активированного комплекса или вблизи от него.
3. Преодоление потенциального барьера вблизи активированного комплекса описывается как поступательное движение системы вдоль координаты реакции. Движение системы (протекание реакции) вдоль координаты реакции возможно только в направлении образования продуктов реакции. Это значит, что активированный комплекс, если уж он образовался, не может превращаться обратно в исходные вещества.
Это свойство принципиально отличает активированный комплекс, описывающий элементарный акт реакции, от свойств промежуточных продуктов, описывающих путь химического превращения и обнаруживаемых физическими методами исследования. Уже само образование активированного комплекса достаточно для осуществления реакции.
Активированные комплексы – это те же частицы или комплексы частиц, отличающиеся только конфигурацией с повышенным запасом энергии и неустойчивые в направлении координаты реакции, их среднее время жизни
τ# = 2πh/kT, (1)
где h и k – постоянные Планка и Больцмана соответственно.
При обычных для химических реакций температурах τ# ≈ -13 с, т. е. близко в времени одного колебания. Такие времена были до сих пор недоступны экспериментально, положение изменилось с появлением фемтосекундной спектроскопии (фемто – 10-15), в которой для идентификации частиц применяли лазеры с импульсами продолжительностью до 10-14 с, т. е. меньше времени одного колебания. В 1999 г. за создание фемтосекундной спектроскопии работы А. Зивейла были отмечены Нобелевской премией.
Таким образом, появилась экспериментальная возможность глубже понять структуру активированного комплекса.
 2014-02-12
2014-02-12 4251
4251








