КАТАЛИЗ И РАВНОВЕСИЕ
Лекция 4
Теория активированного комплекса, теория переходного состояния, или теория абсолютных скоростей реакции была создана в 1930-х г. г, Эйрингом, М. Эвансом и М. Поляни. Она позволяет рассчитывать скорости элементарных химических реакций на основании знания об электронном строении и свойствах молекул реагентов.
В основе теории абсолютных реакций лежит представление о многомерной поверхности потенциальной энергии реакционной системы. В общем случае многомерная поверхность потенциальной энергии системы из N атомов представляет функцию потенциальной энергии U от их внутренних координат или внутренних степеней свободы (вращательных и колебательных).
В системе из N атомов число внутренних степеней свободы
n = 3N - 6 (или n = 3N – 5, если ядра расположены на одной линии).
Простейшая двухмерная поверхность потенциальной энергии (n = 2) для реакции
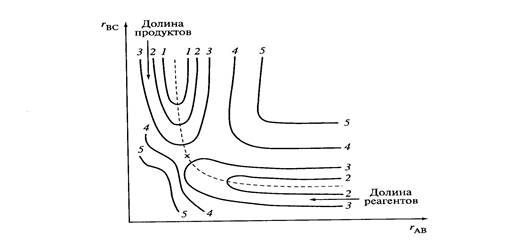
A + BC → AB + C
при расположении атомов А, В и С на одной прямой изображена на рис. 1. По осям координат – расстояния (r) A–B и B–C. Реагентам и продуктам реакции на ней соответствуют относительно небольшие потенциальные энергии (долины), разделенные областью повышенной потенциальной энергии (потенциальный барьер. Штриховую кривую, проходящую по дну долин через потенциальный барьер, называют координатой реакции.
 2014-02-12
2014-02-12 1016
1016