Откуда
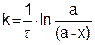 или
или 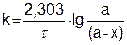 (5.13)
(5.13)
Это уравнение дает возможность вычислить концентрацию реагирующего вещества в любой момент времени по известной величине константы скорости, или найти константу скорости реакции при заданной температуре путем определения концентрации в любой момент времени.
Из уравнения (5.13) следует, что размерность константы скорости реакции первого порядка будет t-1 (например, мин-1 или с -1).
Скорость реакции первого порядка не зависит от объема (разбавления), в котором протекает реакция. Иными словами, в единицу времени превращению подвергается одна и та же часть вещества.
Наряду с константой скорости, реакции характеризуют периодом полураспада (t1/2) – временем, за которое прореагировало половина вещества:
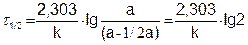 (5.14)
(5.14)
Из уравнения (5.14) следует, что константа скорости реакции первого порядка обратно пропорциональна периоду полураспада.
По закону реакций первого порядка протекают в основном физические процессы: диффузия, растворение, радиоактивный распад; и некоторые химические реакции: гидролиз полисахаридов и т.д.
К реакциям второго порядка относятся реакции соединения типа А + В → С или обмена А + В → С + D, а так же реакции разложения и др. Скорость реакции второго порядка определяется уравнением:
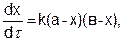 (5.15)
(5.15)
где k – константа скорости, a и b – число молей веществ А и В в начальный момент времени, х – число прореагировавших молей.
Здесь возможны два случая. Первый случай, когда вещества а и b вступают в реакцию в эквивалентных количествах (a = в) и второй, когда (a ≠ в). Рассмотрим оба случая.
Первый случай (a = в). Уравнение (5.15) принимает вид
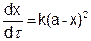 (5.16)
(5.16)
Разделяя переменные и проводя интегрирование, получим
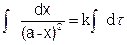 (5.17)
(5.17)
Откуда
1/(а – х) = kt + const. (5.18)
При t = 0, x = 0
const = 1/а (5.19)
Подставив уравнения (5.19) в (5.18), получим
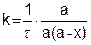 (5.20)
(5.20)
Размерность константы скорости реакции первого порядка [мин-1(моль/дм3)-1]. В данном случае скорость реакции зависит от разбавления раствора или его концентрации.
Второй случай (a ≠ в). Если для реакции взяты неэквивалентные количества реагирующих веществ, то
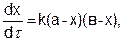 (5.21)
(5.21)
После разделения переменных получим это уравнение в другом виде:
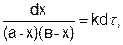 (5.22)
(5.22)
Выражение, стоящее в левой части уравнение (5.22), можно представить как
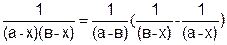 .
.
После подстановки этого выражения в уравнение (5.22) получим
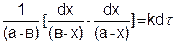 (5.23)
(5.23)
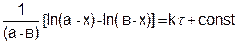 (5.24)
(5.24)
Поскольку при t = 0, x = 0, постоянная интегрирования равна
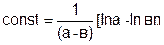 (5.25)
(5.25)
Таким образом, подставляя это выражение в уравнение (5.24), найдем
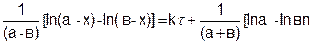
Откуда
k = 1/t • 2,303/(а – в)[ln(в(а – х)/а(в – х)] (5.26)
Это и есть кинетическое уравнение реакции второго порядка при условии (a ≠ в).
Определить, какого порядка данная реакция можно, используя метод подстановки. Для этого из реакционной смеси отбирают пробы через определенный промежуток времени и анализируют на содержание исходных веществ. Затем полученные значения подставляют в кинетические уравнения первого или второго порядка. И тем уравнением, где константа скорости в ходе процесса не меняется, определяется и порядок реакции.
 2014-02-12
2014-02-12 1161
1161








