Карбоксильная группа состоит из карбонильной и гидроксильной групп, которые взаимно влияя друг на друга приводят к новому качеству.
Рассмотрим реакционные центры в молекулах карбоновых кислот:
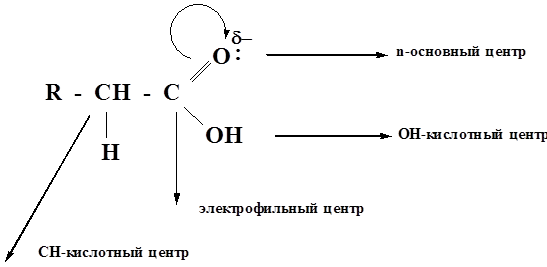
Исходя из электронного строения и электронных эффектов (индуктивного и мезомерного) можно охарактеризовать реакционную способность карбоновых кислот следующим образом:
1. У карбоновых кислот повышены основные свойства атома кислорода по сравнению с оксосоединениями.
2. За счет р,π-сопряжения в карбоксильной группе кислотность по сравнению со спиртами сильно повышена.
3. У карбоновых кислот частичный положительный заряд на карбоксильном атоме углерода меньше, чем в оксосоединениях, т.е. кислоты менее активны к восприятию атаки нуклеофильным реагентом, поэтому для кислот характерны реакции SN, а не AN, как для оксосоединений.
4. За счет одновременного наличия и кислотных и основных центров, карбоновые кислоты способны к ассоциации и, как правило существуют в виде димеров.
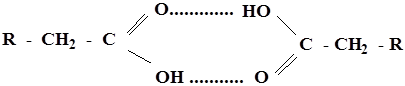
5. По легкости вступления в реакции SN производные карбоновых кислот можно расположить в следующем порядке:
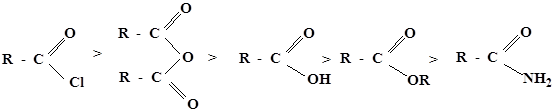
9.3 Реакции SN
Реакции SN характерны для карбоновых кислот и их функциональных производных, что обусловлено полярностью связи С - Х (Х - ОН; -Наl; ОR; -OCOR; -NH2 и т.д.).
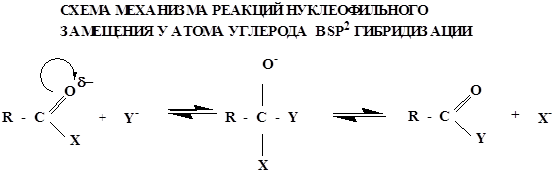
По такому механизму реакция протекает при наличии сильного нуклеофила Y- и хорошо уходящей группы Х- . Увеличение реакционной способности карбоновых кислот в SN- реакциях осуществляется путем повышения электрофильности атома углерода карбоксильной группы, что достигается либо использованием кислотного катализа
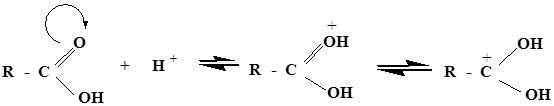
либо введением в карбоксильную группу более сильных электроноакцепторов, чем ОН-группа, например галогена:
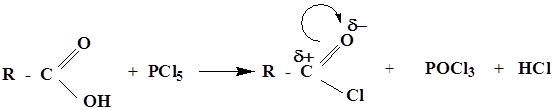

Реакция этерификации и гидролиз сложных эфиров – это наиболее важные реакции SN, имеющие аналогии в биологических системах.
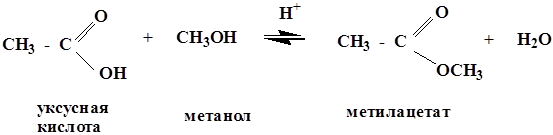
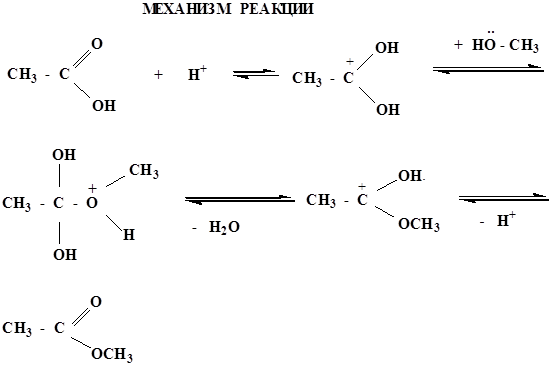
реакция протекает в присутствии минеральных кислот, т.к. спирт является слабым нуклеофилом. Все стадии обратимы, поэтому образующиеся сложные эфиры являются нестойкими соединениями и гидролизуются в кислой среде.
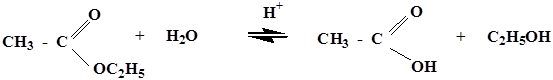
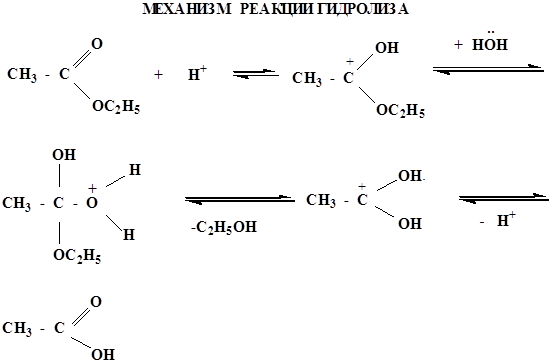
в щелочной среде гидролиз необратим, причиной этого является образование в щелочной среде стабильного ацилат-иона. Рассмотрим механизм щелочного гидролиза на примере гидролиза изопропилацетата.
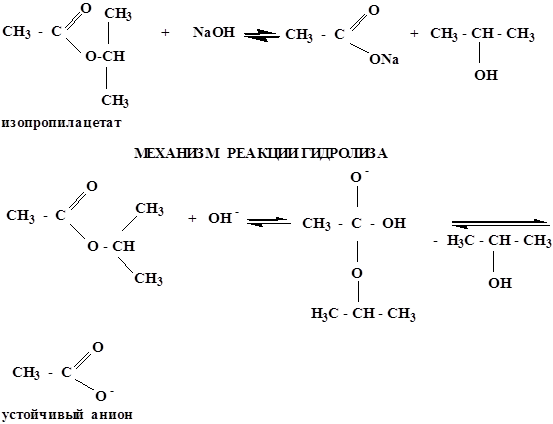
Для практического получения сложных эфиров обычно используют реакцию ацилирования спиртов галогенангидридами или ангидридами кислот, при этом выход эфиров составляет от 60 до 80 % (в отличие от ацилирования кислотами, где выход составляет приблизительно 30 – 40 %).
Сложными эфирами являются жиры и липиды, в образовании которых принимают участие многоатомные спирты ВЖК
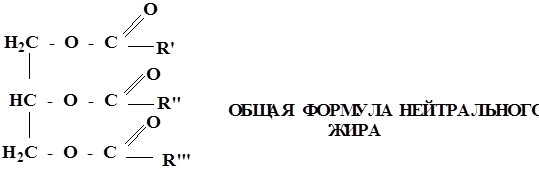
Многие лекарственные препараты являются сложными эфирами. Поэтому всегда следует учитывать возможность их гидролиза в кислой среде желудка и щелочной – кишечника.
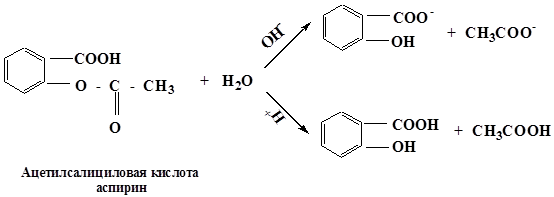
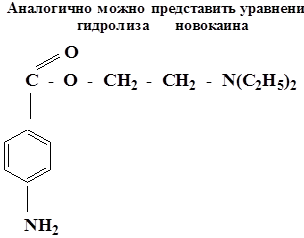
Сложные тиоэфиры R - C = О наряду со сложными эфирами
│ являются наиболее распространенными
SR в природе производными карбоновых кислот. В организме таким представителем биологически-активных тиоэфиров является ацетил КоА
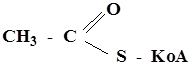 Ацетил КоА in vivo служит переносчиком ацетильной группы
Ацетил КоА in vivo служит переносчиком ацетильной группы
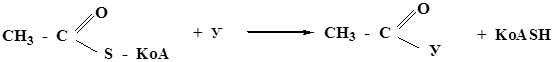
Таким образом осуществляется превращение холина в ацетилхолин – нейромедиатор, посредник при передаче нервного импульса.
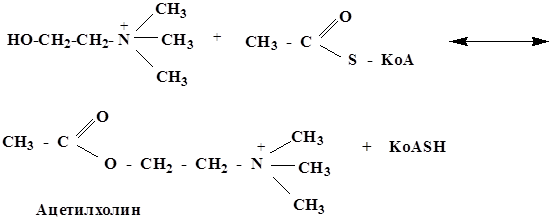
Ацетилхолин синтезируется в окончаниях нервных волокон и мигрирует к белковому рецептору следующей нервной клетки. Так происходит передача нервного импульса. Связывание ацетилхолина с белковым рецептором является причиной передачи сигнала далее, а ацетилхолин гидролизуется, оставляя клетку готовой для приема следующего сигнала.
 2014-02-13
2014-02-13 5371
5371








