План.
- Классификация. Номенклатура.
- Галогенангидриды карбоновых кислот. Методы синтеза. Физические и химические свойства.
- Ангидриды карбоновых кислот. Методы синтеза и химические свойства.
- Сложные эфиры. Методы получения. Химические свойства.
- Синтезы на основе эфиров 1,3-кетокислот.
- Амиды карбоновых кислот. Методы получения и химические свойства. Нитрилы карбоновых кислот.
- Производные угольной кислоты.
Функциональные производные карбоновых кислот можно рассматривать как результат замещения гидроксильной группы кислоты на какую-либо другую группу Х. Эти вещества могут быть гидролизованы в кислоту в соответствии с уравнением.
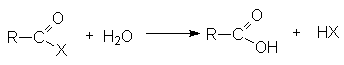
К таким соединениям относят
| галогенангидриды | 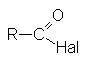 |
| сложные эфиры | 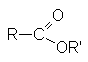 |
| ангидриды | 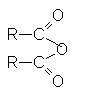 |
| амиды | 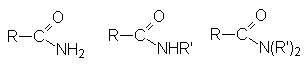 |
| имиды | 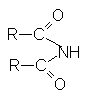 |
Общим элементам структуры этих соединений является ацильная группа
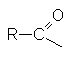
Однако нитрилы R-Cº N также часто рассматриваются как производные карбоновых кислот, поскольку их гидролиз приводит к карбоновым кислотам.
ГАЛОГЕНАНГИДРИДЫ КАРБОНОВЫХ КИСЛОТ
Соединения этого ряда выражаются формулой:

Названия соединений этого ряда складывается из названия ацильного радикала и галогена с окончанием "ид".
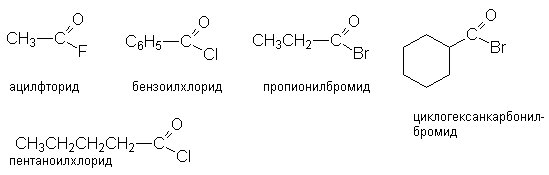
Методы получения
- Взаимодействие карбоновых кислот с галогенангидридами неорганических кислот (SOCl2, SO2Cl2, PCl3, POCl3, PCl5, PBr5, COCl2)
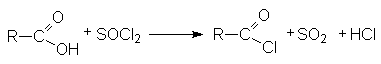
Так получают бромиды и хлориды.
- Реакции диспропорционирования с галогенангидридами органических кислот (оксалилхлорид, бензоилхлорид).
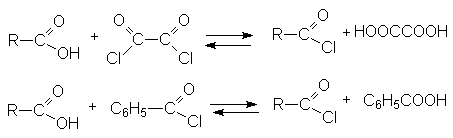
Эти реакции лежат в основе синтеза ацилхлоридов.
Физические свойства и строение
Ацилгалогениды представляют собой бесцветные жидкости или кристаллические вещества с острым запахом, легколетучие, на воздухе "дымят". Низшие ацилфториды газообразны. В воде растворяются плохо, но быстро с ней реагируют. В ацильной группе заряд на карбонильном углероде существенно завышен по сравнению с карбонильным углеродом карбоновых кислот из-за сильных электроакцепторных свойств атомов галогенов
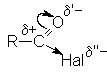
Это обусловливает высокую склонность галогенангидридов к взаимодействию с нуклеофильными реагентами.
Химические свойства
Реакции нуклеофильного замещения
Ацилгалогениды легко реагируют с различными нуклеофильными реагентами, причем эти реакции не требуют катализа. Общая схема этих реакций может быть представлена уравнениями
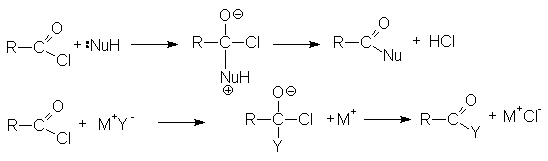
Важными реакциями нуклеофильного замещения по ацильному углероду являются:
- Гидролиз
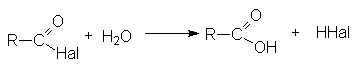
- Взаимодействие со спиртами (этерификация)
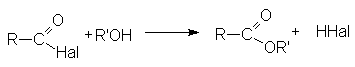
- Взаимодействие с аммиаком и аминами (аммонолиз)
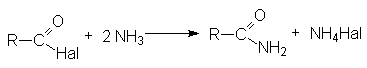
- Взаимодействие с гидразином и его производными
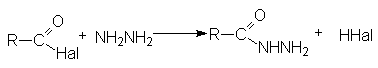
- Взаимодействие с металлоорганическими соединениями
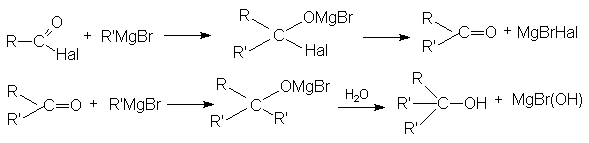
По этому суммарно реакцию можно представить следующей схемой
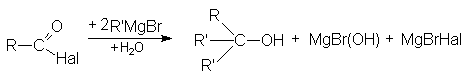
Реакции восстановления
- Восстановление натрийборгидридом или литийалюминий гидридом.
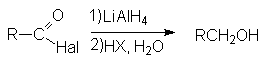
- Восстановление по Розенмунду
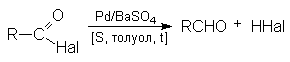
Реакция с диазометаном (реакция Арндта-Эйстерта)
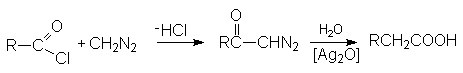
Эта реакция является синтетическим средством увеличения длины углеводородных цепей органических соединений на один атом углерода.
АНГИДРИДЫ КАРБОНОВЫХ КИСЛОТ
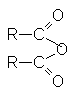
Строение ангидридов выражается следующей общей формулой
Методы получения
- Термическая дегидратация карбоновых кислот.
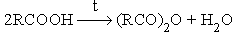
- Взаимодействие карбоновых кислот с водоотнимающими агентами.
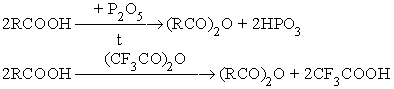
- Взаимодействие ацилгалогенидов с карбоновыми кислотами.
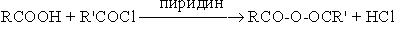
Таким способом получают несимметричные ангидриды.
- Взаимодействие ацилгалогенидов с солями карбоновых кислот.
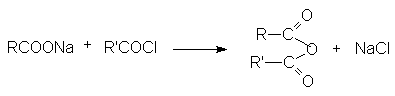
- Взаимодействие кетена и карбоновых кислот.
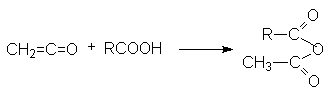
Химические свойства ангидридов карбоновых кислот
О дна ацильная группа действует на другую как сильный акцептор, поэтому на карбонильном атоме углерода концентрируется достаточно высокий положительный заряд. Это обусловливает высокую реакционную способность ангидридов в реакциях нуклеофильного замещения
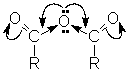
Реакция нуклеофильного замещения
Ангидриды карбоновых кислот легко реагируют с различными нуклеофильными реагентами, хотя скорость реакции меньше, чем в случае ацилгалогенидов.
Общий механизм реакции ангидридов карбоновых кислот с нуклеофилом может быть представлен схемой:
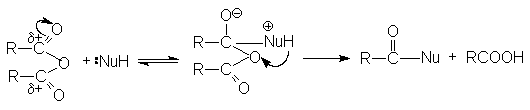
Можно видеть, что в результате реакции кроме продукта нуклеофильного
замещения 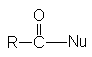 образуется карбоновая кислота.
образуется карбоновая кислота.
Важнейшими реакциями нуклеофильного замещения с участием ангидридов карбоновых кислот является:
- Гидратация.
(RCO)2O + H2O ® 2RCOOH
- Этерификация.
(RCO)2O + R'OH ® RCOOR' + RCOOH
- Взаимодействие с аммиаком и аминами (аммонолиз).
(RCO)2O + 2NH3 ® RCONH2 + RCOONH4
К е т е н
Кетен формально может рассматриваться как ангидрид уксусной кислоты.
CH2=C=O + H2O ® CH3CHO
Кетен получают следующими методами:
- Пиролизом кетонов или карбоновых кислот на фосфатных катализаторах.
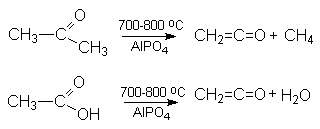
- Отщепление галогеноводорода от ацилхлоридов в присутствии сильного органического основания, например, третичного амина.
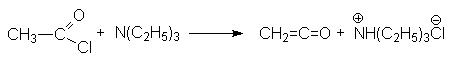
- Дегалогенирование a - галогенацилгалогенида
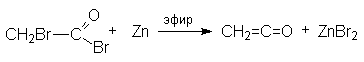
Химические свойства
Химическое поведение кетена определяют два фактора: напряженность
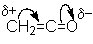
молекулы и высокий положительный заряд на карбонильном углероде
Наиболее типичными реакциями кетенов являются реакции нуклеофильного присоединения.
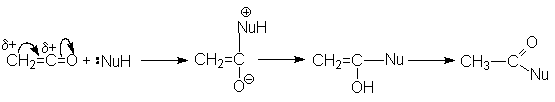
Наиболее важными среди этих являются реакции гидратации, образования ангидридов сложных эфиров и амидов карбоновых кислот:
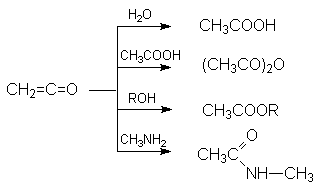
Поскольку в результате этих реакций не образуется каких-либо других продуктов, то кетен является идеальным ацилирующим агентом.
СЛОЖНЫЕ ЭФИРЫ
Сложные эфиры – производные карбоновых кислот, которые можно рассматривать как результат замещения гидроксильной группы карбоновой кислоты на алкоксирадикал

Методы получения сложных эфиров:
- Этерификация карбоновых кислот (см. химические свойства карбоновых кислот).
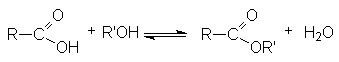
- Ацилирование спиртов галогенангидридами и ангидридами карбоновых кислот.
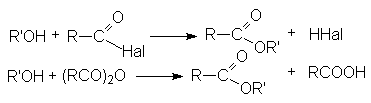
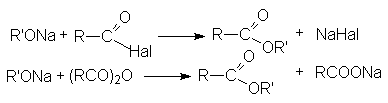
- Ацилирование алкоголятов галогенангидридами и ангидридами карбоновых кислот.
- Алкилирование солей карбоновых кислот.
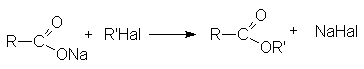
- Этерификация амидов и нитрилов карбоновых кислот.
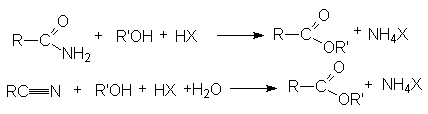
- Синтез метиловых эфиров взаимодействием карбоновых кислот с диазометаном.
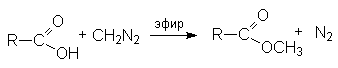
Механизм реакции:
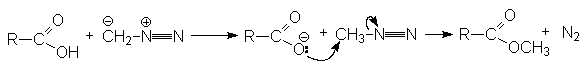
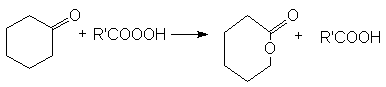
- Реакция Байера-Виллигера
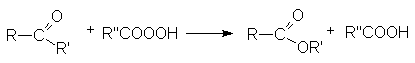
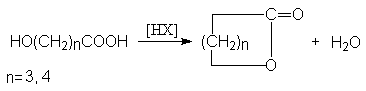
Методы синтеза лактонов (циклических сложных эфиров)
- Внутренняя этерификация g - и d -оксикарбоновых кислот.
- Реакция Байера-Виллигера
Физические свойства и строение сложных эфиров
Сложные эфиры являются бесцветными жидкостями или кристаллическими веществами с приятным запахом. Температура кипения сложных эфиров обычно ниже чем температура близких по молекулярной массе карбоновых кислот. Это свидетельствует об уменьшении межмолекулярных взаимодействий, что объясняется отсутствием межмолекулярных водородных связей.
Полярность связей в молекуле сложного эфира подобна полярности связи в карбоновых кислотах.
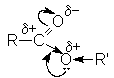
Основное отличие от карбоновых кислот – отсутствие подвижного протона, вместо него находится углеводородный остаток. Электрофильный центр находится на карбонильном и алкильном углеродном атоме. В то же время карбонильный кислород обладает основностью.
Химические свойства
Объектами нуклеофильной атаки могут быть ацильный или алкильный углерод. В то же время кислотность водородных атомов при a -углеродном атоме радикала кислоты обусловливает склонность сложность эфиров к реакции конденсации.
Реакции нуклеофильного замещения
- Гидролиз.
Различают кислотнокаталитический гидролиз и основной гидролиз (омыление). Кислотный гидролиз представляет собой обратимую реакцию.
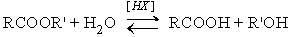
Механизм этой реакции – см в разделе Кислотно-каталитическая этерификация – Химические свойства карбоновых кислот.
Реакция омыления необратима. Основание не только ускоряет реакцию гидролиза, но выступает в качестве реагента. Эффективность реакции обусловлена высокой нуклеофильной активностью гидроксил-анионов.
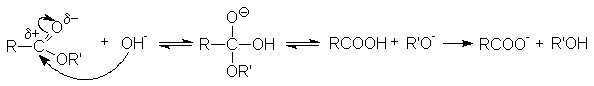
RCOOR' + NaOH ® RCOONa + R'OH
- Аммонолиз.
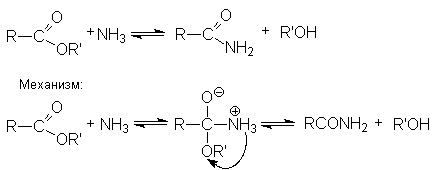
- Переэтерификация.
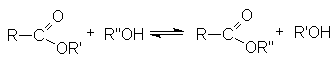
Реакция катализируется кислотами или основаниями.
- Взаимодействие с магний- и литий-органическими соединениями.
а) Реакция с магнийорганическими соединениями подобна реакции с галогенангидридами.
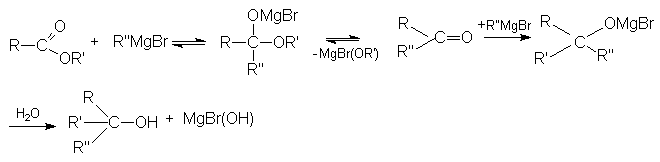
б) Взаимодействие с Li-органическими соединениями.
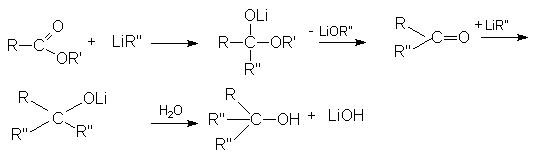
Реакции восстановления.
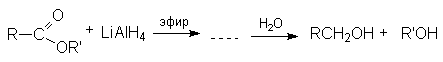
Реакции конденсации
Конденсация Кляйзена – наиболее важная в синтетическом отношении реакция. Ее стехиометрический результат заключается в автоконденсации этилацетата, катализируемая этилатом натрия.
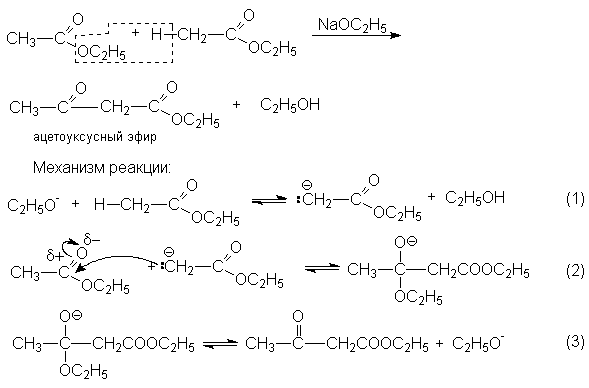
Условия равновесия неблагоприятны для всех трех стадий. Поэтому равновесие брутто-реакций существенно смещено в левую сторону.
Факторами смещения равновесия могут быть: отгонка этилового спирта, применение избытка этилата натрия. Последний метод оказывается эффективным, так как этанол более слабая кислота, чем енол сложного эфира, и избыток этилата смещает равновесие нацело вправо вследствие превращения b -кетоэфира в соль енола.
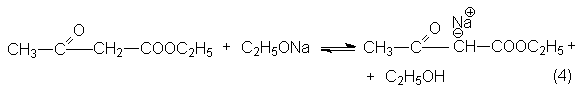
Очевидно, что продукт конденсации необходимо получить из соли енола и выделять в условиях, предотвращающих обратную реакцию распада на исходные реагенты. Наилучшим методом оказывается "замораживание" реакционной смеси для чего ее вливают в избыток холодной кислоты.
Для протекания конденсации Кляйзена необходимы следующие структурные предпосылки: исходный эфир должен иметь водородный атом при a -углеродном атоме, чтобы могли осуществиться реакции, представленные в механизме (реакции (1)-(3)) и два водородных атома при a -углероде, для того чтобы оказалось возможным смещение равновесия реакции в сторону продукта за счет образования енолят-аниона ацетоуксусного эфира.
Очевидно, что этилизобутират не вступает в присутствии этилата натрия в реакцию автоконденсации, поскольку в продукте конденсация отсутствует a -водородные атомы.
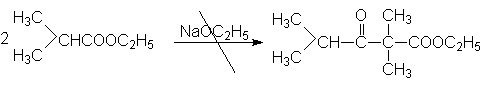
Конденсация Кляйзена может быть проведена между двумя сложными эфирами, но поскольку при этом возможно образование четырех различных продуктов, в результате реакции часто получают сложные смеси. Этого удается избежать, если один из сложных эфиров не содержит a -водородных атомов и легко реагируется с карбанионом. Реакции в этом случае напоминают перекрестную альдольную конденсацию. К числу применимых для этой цели сложных эфиров, не содержащих a -водородные атомы и обладающих высокой реакционной способностью относятся эфиры бензойной, муравьиной, щавелевой и угольной кислот.
Примеры:
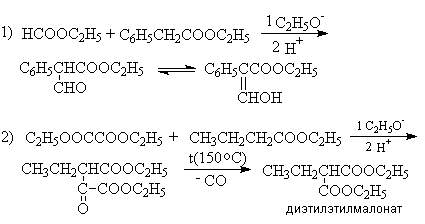
 2015-04-23
2015-04-23 15154
15154
