Как мы выяснили, переход вещества из одной фазы в другую происходит при отсутствии равновесия между фазами.
Пусть имеются две фазы G и L, причем распределяемое вещество вначале находится только в первой фазе G и имеет концентрацию Y. Если привести фазы в соприкосновение, то распределяемое вещество начнет переходить в фазу L. С момента появления распределяемого вещества в фазе L начнется и обратный его переход в фазу G.
Скорость обратного перехода будет увеличиваться по мере повышения концентрации распределяемого вещества в фазе L. В некоторый момент скорости перехода вещества из фазы G в фазу L и обратно станут одинаковыми. При этом установится состояние равновесия между фазами, при котором преимущественного перехода вещества из одной фазы в другую происходить не будет.
В состоянии равновесия существует определенная зависимость между концентрациями распределяемого вещества в обеих фазах – любой концентрации X этого вещества в фазе L соответствует равновесная концентрация его Yр в фазе G:
Yp = f(X).
Условие равновесия, выраженное последним уравнением, позволяет определить направление процесса. Если рабочая концентрация Y распределяемого вещества в фазе G больше равновесной (Y > Yp), вещество будет переходить из фазы G в фазу L. Если же Y < Yp, вещество переходит из фазы L в фазу G.
Равновесие между фазами можно представить графически на Y – X-диаграмме (рис. 6.3). На этой диаграмме по оси абсцисс откладывается концентрация X распределяемого вещества в фазе L, а по оси ординат – его концентрация Y в фазе G. Кривая ОС, изображающая зависимость равновесной концентрации Yp от X, называется линией равновесия.
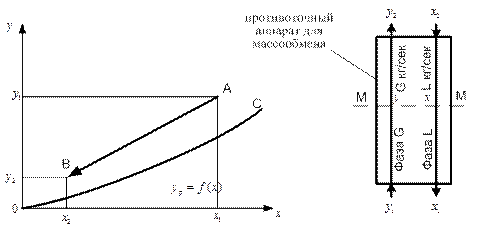
ОС – линия равновесия; АВ – рабочая линия
Рисунок 6.3 – Диаграмма Y – X и схема движения потоков в противоточном
аппарате для массообмена
 2014-02-13
2014-02-13 802
802








