| Комплекс | Центральный ион металла М |
| [M(CN)2]- [М(СN)3]n- [M(CN)4]n- [М(СМ)5]n- [M(CN)6]n- [M(CN)8]n- | Cu(I), Ag(I) Cu(I), Ag(I), Mn(I), Ni(I), n=2; Zn(II), Hg(II), Cd(II), n=l Си(I), Ag(I), n=3; Zn(II), Cd(II), Mg(II), Cu(II), Ni(II), Pd(II), Pt(II), n=2; Fе(III), Au(III), n=1 Mo(IV), n=l Mn(I), n=5; Cd(II), V(II), Cr(II), Мn(II), Fe(II), Со(II), Ru(II), Os(II), n=4; V(III), Cr(III), Мn(III), Fe(III), Rh(III), Ir(III), Co(III), n=3; V(IV), Pt(IV), n=2 Mo(IV), W(IV), n=4; Mo(V), W(V), n=3 |
Среди Ц. металлов гр. V6 наиб. известны соед. V, образующего простой Ц. и разл. комплексы с лигандом CN-. Для Nb(V) известны только гетеролигандные координационные Ц. При взаимод. NbCls с HCN в диэтиловом эфире образуется NbCl4(CN) х (C2H5)2O. Среди координац. соед. на основе цианидов Сг, Mo, W наиб. стабильны производные Сr(III), Mo(IV), W(IV) и W(V), напр. K3[Cr(CN)6], к-рый получают действием избытка KCN на ацетат Сr(III) в водном р-ре. Для Мn(II) синтезированы Ц. смешанного типа и комплексы с мостиковой группой CN. Для металлов семейства Fe известны простые Ц. общей ф-лы M(CN)2, где M-Fe, Co, Ni, и комплексные, устойчивые в водных р-рах. Многочисленную группу соед. составляют соли гексацианоферратной(II) к-ты H4[Fe(CN)6] (см. Калия гексацианоферраты), полученной в р-ре и твердом состоянии, напр.: K4[Fe(CN)6] (желтая кровяная соль), KFe[Fe(CN)6] (р-римая берлинская лазурь) и Fe4[Fe(CN)6]3 - гексацианоферрат(II) железа(III) (нерастворимая берлинская лазурь), к-рые входят в состав пигмента железная лазурь. Октаэдрич. парамагн. ион [Fe(CN)6]3-, будучи более реакционноспособным, чем диамагнитный [Fe(CN)6]4-, ведет себя как сильный окислитель, особенно в щелочной среде. Напр., при взаимод. K3[Fe(CN)6] (красная кровяная соль) с солями Fe(II) протекает окислит.-восстановит, р-ция: Fe2+ + [Fe(CN)6]3- ——> Fe3+ + [Fe(CN)6]4-. Образующаяся турнбуллева синь, как и берлинская лазурь, отвечает, в осн., гексацианоферрату(II) железа(III). Замена одного из CN-лигандов в октаэдрич. комплексе [Fe(CN)6]4- на ацидогруппу или нейтральный лиганд (Н2О, NH3, CO, NO) приводит к образованию гетеролигандных соед., напр. пентацианонитрозилийферрата(II) натрия (нитропруссида натрия) - Na2[Fe(CN)5(NO)+] x 2Н2О. Простые Ц. платиновых металлов получены для Ru, Rh, Ir, Pd и Pt. Комплексные Ц. известны для всех платиновых металлов и характеризуются большей устойчивостью по отношению к р-циям гидролиза, окислит.-восстановит. р-циям, замещению группы CN, чем соед. Fe и Со. Ц. в гальванотехнике используют для получения металлич. покрытий, напр. применяют Nа3[Си(СN)4], Na2[Zn(CN)4], K[Ag(CN)2] и др. Обработка металлич. пов-стей, напр. Ti или его сплавов Ц. при 800 °С, улучшает их мех. и антикоррозионные св-ва благодаря образованию нитридов или карбидов. Многие Ц., в осн. координационные, используют в качестве катализаторов ряда хим. процессов, в произ-ве пигментов, малярных, типографских красок и др., Простые Ц. - сильнейшие яды, вызывают удушье вследствие паралича тканевого дыхания, что приводит к сердечной недостаточности.
Оксид углерода (IV). Строение молекулы. Физические и химические свойства. Влияние углекислого газа на окружающую среду. Получение. Угольная кислота и её соли. Строение карбонат-иона. Термическая устойчивость солей угольной кислоты. Мочевина. Соли мочевины. Применение.
Оксид углерода (IV) CO2 Строение молекулы
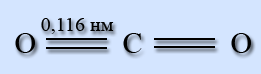
Молекула СО2 линейная, длина двойной связи С=О равна 0,116 нм.
В рамках теории гибридизации атомных орбиталей две σ-связи образованы sp-гибридными орбиталями атома углерода и 2р-орбиталями атома кислорода. Не участвующие в гибридизации р-орбитали углерода образуют с аналогичными орбиталями кислорода p-связи. Молекула неполярная.
Физические свойства Оксид углерода (IV) – углекислый газ, газ без цвета и запаха, тяжелее воздуха, растворим в воде, при сильном охлаждении кристаллизуется в виде белой снегообразной массы – «сухого льда». При атмосферном давлении он не плавится, а испаряется, температура сублимации -78 °С. Углекислый газ образуется при гниении и горении органических веществ. Содержится в воздухе и минеральных источниках, выделяется при дыхании животных и растений. Мало растворим в воде (1 объем углекислого газа в одном объеме воды при 15 °С).
Химические свойства. Химически оксид углерода (IV) инертен.
Окислительные свойства С сильными восстановителями при высоких температурах проявляет окислительные свойства. Углем восстанавливается до угарного газа:
С + СО2 = 2СО.
Магний, зажженный на воздухе, продолжает гореть и в атмосфере углекислого газа:
2Mg + CO2 = 2MgO + C.
 2015-01-30
2015-01-30 2514
2514








