В аптеках городских клинических больниц готовят раствор Рингера следующего состава:
Натрия хлорида....................................................................................................0,9
Калия хлорида....................................................................................................0,02
Кальция хлорида................................................................................................0,02
Натрия гидрокарбоната.....................................................................................0,02
Воды для инъекций до..................................................................................100 мл
При проведении реакций идентификации на ион калия была использоввана фармакопейная реакция с раствором кислоты виннокаменной и натрия ацетата в соответствующих условиях; выпадения белого кристаллического осадка не наблюдалось.
· Дайте объяснение полученному результату и укажите, какую реакцию идентификации можно предложить для достоверного доказательства иона калия в данном растворе.
· Приведите русское, латинское и рациональное название препарата. Охарактеризуйте физико-химические свойства (внешний вид, растворимость) и их использование для оценки качества.
· В соотвествии с химическими свойствами предложите реакции идентификации и методы количественного определения. Напишите уравнения реакций.
Реакции обнаружения
Na+, K+, Ca2+ при совместном присутствии
1)Na+ с пикриновой кислотой, образуются мелкие кристаллы игольчатой формы желтого цвета
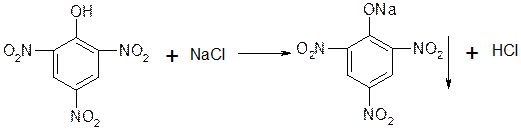
2)К+ образует с реактивом Фишера в среде CH3COOH желтый кристаллический осадок
 2КСI + Na3[CO(NO2)6] = K2Na[Co(NO2)6] + 2NaCI
2КСI + Na3[CO(NO2)6] = K2Na[Co(NO2)6] + 2NaCI
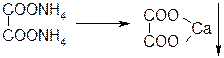 |
3) CaCI2 + + 2NH4Cl
4)Na+ осаждают с цинкуранилацетатом
NaCI + Zn(UO2)3(CH3COO)8 + CH3COOH + 9H2O → NaZn[(UO2)3(CH3COO)9]´9H2O + HCI
На К+ с винной кислотой реакция нецелесообразна, т.к. среда слабо щелочная, не будет образования кислой соли KHC4H4O6 осадка белого цвета.
Количественное определение хлоридов натрия, калия и кальция.
1)Методика определения при совместном присутствии:
å NaCI, CaCI2, KCI – к 1 мл раствора прибавляют 2-3 капли K2CrO4 и титруют 0,1 моль/л AgNO3 до буровато-желтого цвета осадка
CI- + Ag+ → AgCI↓ белого
В т.экв. 2Ag+ + CrO4 2- → Ag2CrO4 ↓ кирпично-красного
СaCI2. К 5 мл раствора прибавляют 3 мл аммиачного буферного раствора, 0,02 г индикаторной смеси кислотного хрома темно-синего и титруют (0,01 моль/л) ТрБ до сине-фиолетовой окраски.
ТСаCI2 / ТрБ 0,01 моль/л = 219,08*0,01 / 1000= 0,00219 г/мл
Расчет Тср ориентир на å хлоридов:
Мм NaCI = 58,44 fэкв = 1
Мм KCI = 74,56 fэкв = 1
Мм СaCI2 =219,08 fэкв = ½
Т NaCI / 0,1м/л AgNO3 = 58,44*0,1 / 1000 = 0,005844 г/мл
Т KCI / 0,1 м/л AgNO3 = 74,56*0,1 / 1000 = 0,007456 г/мл
Т СaCI2 / 0,1 м/л AgNo3 = (219,08/2)*0,1 / 1000 = 0,01095 г/мл
В 1 мл ЛФ содержится:
NaCI – 0,009
KCI – 0,0002
СaCI2 – 0,0002
Рассчитываем объем титранта:
V1 (на NaCI) = 0,009 / 0,005844 = 1,54 мл
V2 (на КСI) = 0,0002 / 0,007456 = 0,027 мл
V3 (CaCI2) = 0,0002 / 0,01095 = 0,018 мл
å веществ = 0,009 + 0,0002 + 0,0002 = 0,0094
åV = 1,54 + 0,027 + 0,018 = 1,585 мл AgNO3
Tср= 0,0094 / 1,585 = 0,00593 г/мл
VТрБ = 0,001 / 0,00219 = 0,46 мл ТрБ /:5 /:2 = 0,0456 мл
В 5 мл 0,0002*5=0,001
å веществ = 0,009 + 0,0002 = 0,0092 (NaCI + KCI)
å VАgNO3 = 1,585 – 0,0456 = 1,539 мл
Тср (NaCI, KCI) = 0,0092 / 1,539 = 0,005976 г/мл
2)Возможно меркуриметрия определения хлоридов (среда HNO3)
Химизм: Hg2+ + 2Hal– → HgHal2
Образуется малодиссоциированное соединение HgCI2 (сумма)
Ind дифенилкарбазон, титруют до желтого окрашивания
3)СaCI2 определяется комплексонометрическим методом
среда – аммиачно-буферный раствор
Ind – кислотный хром темно-синий
Титр 0,05 М раствор ТрБ. До сине-фиолетового окрашивания.
Icт. H2Ind +CaCI2 → CaInd + 2HCI
IIст.
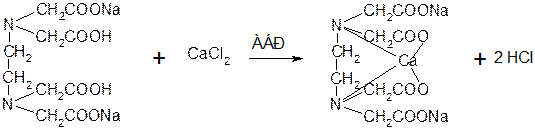
IIIст. СаInd + H2ТрБ = CaТрБ + H2Ind
Fэкв = 1 ФПТ
 2015-01-30
2015-01-30 3646
3646
