Первое начало термодинамики определяет внутреннюю энергию газа как некоторую термодинамическую функцию состояния системы.
Термодинамической функцией, независящей от пути перехода газа из одного состояния в другое, а зависящей только от начального и конечного состояния системы, является также величина, называемая энтропией S.
Изменение этой величины задается отношением отдаваемого или принимаемого тепла к температуре теплопередачи:
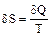 (2.3.1)
(2.3.1)
Для изотермического процесса в газе согласно 2.1.2
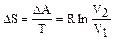
Так как температура системы пропорциональна средней кинетической энергии, приходящейся на одну степень свободы беспорядочного движения газовых молекул, то энтропия газа при температуре Т показывает число «носителей» энергии в 1 моле газа:
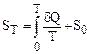
Нулевое значение энтропии S0=0 соответствует состоянию газа, при котором отсутствует беспорядочное движение его молекул, что имеет место при температуре абсолютного нуля. В изолированных адиабатических процессах энтропия системы остается постоянной, так как dQ=0 и при T¹0 dS=0, т.е. S=const.
Для обратимого процесса, график которого в координатах р,V образует контур,
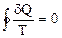 (2.3.2)
(2.3.2)
В случае необратимого цикла 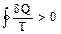
В молекулярно- статическом смысле энтропия представляет собой величину, пропорциональную логарифму вероятности термодинамического состояния вещества S=klnW. Таким образом, энтропию системы можно рассматривать как количественную меру беспорядка в системе.
Естественные процессы стремятся перевести систему в состояние с большим беспорядком.
 2015-01-30
2015-01-30 935
935








