по бухгалтерскому учету и анализу
на тему: «…………………………………………………»
(вариант № ___)
Выполнил: студент…………….
курса……………….
(………)
№ шифра зачетной книжки
Проверил: к.э.н., доцент
Хаустова Г.И.
Воронеж 2012
С КУРСОМ ЭКОЛОГИИ
ГИГИЕНИЧЕСКАЯ ОЦЕНКА ПИТЬЕВОЙ ВОДЫ
РЯЗАНЬ, 2003
ТЕМА: "ГИГИЕНИЧЕСКАЯ ОЦЕНКА ПИТЬЕВОЙ ВОДЫ"
Занятие 1. Методы определения органолептических свойств и жесткости воды, их гигиеническая оценка.
Учебная цель:
I. Ознакомить студентов с санитарно-гигиеническими нормативами на питьевую воду.
2. Ознакомить студентов с принципами гигиенического нормирования и контролем за качеством питьевой воды.
САМОСТОЯТЕЛЬНАЯ РАБОТА СТУДЕНТОВ
а) Определение органолептических свойств воды
б) Определение жесткости воды.
КОНТРОЛЬНЫЕ ВОПРОСЫ
1. Физиолого-гигиеническое значение воды
2. Эпидемиологическое значение воды
3. Требования к качеству питьевой воды согласно Санитарным правилам и нормам СанПиН 2.1.4.1074-01 «Питьевая вода. Гигиенические требования к качеству воды централизованных систем питьевого водоснабжения. Контроль качества»
4. Гигиенические требования к источникам хозяйственно-питьевого водоснабжения, изложенные в ГОСТе 2761-84 "Источники централизованного хозяйственно-питьевого водоснабжения".
5. Гигиенические требования к источникам децентрализованного водоснабжения согласно Санитарно-эпидемиологическим правилам и нормативам СанПиН 2.1.4.1175-02 «Гигиенические требования к качеству воды нецентрализованного водоснабжения. Санитарная охрана источников.»
6. Органолептические свойства воды. Методы определения.
7. Жесткость воды, гигиеническое значение. Метод определения.
Жизнедеятельность человека неразрывно связана с различными факторами окружающей среды, одним из которых является вода. Вода является главной составной частью всего органического мира.
ОПРЕДЕЛЕНИЕ ФИЗИЧЕСКИХ И ОРГАНОЛЕПТИЧЕСКИХ СВОЙСТВ ВОДЫ
Определение температуры воды.
Измерение температуры воды проводится ртутным термометром со шкалой до 100oC и делениями 0,1o непосредственно в пункте выемки воды в водоисточнике или в сосуде емкостью не менее 1 л, куда заливают только что взятую пробу, причем стенки сосуда должны быть ограждены от источников тепла и холода. Отсчет градусов проводят через 5 минут после погружения термометра в воду.
Определение вкуса, запаха и цветности воды.
Определение интенсивности запаха в исследуемой воде проводят при температуре 20°С. В широкогорлую колбу емкостью 250-300 мл отмеривают 100 мл испытуемой воды, колбу закрывают пробкой, содержимое колбы несколько раз перемешивают и определяют характер и интенсивность запаха.
Затем ведут определение запаха при температуре 60°С, для чего колбу с испытуемой водой подогревают на водяной бане до 60°С, горлышко колбы закрывают часовым стеклом. После нагревания содержимое колбы перемешивают, открывают часовое стекло и определяют характер (природу), а также интенсивность запаха, оценивая его по шестибалльной шкале.
СИМВОЛЫ И ТЕРМИНЫ, ХАРАКТЕРИЗУЮЩИЕ ЕСТЕСТВЕННЫЙ ЗАПАХ ВОДЫ
| Характер запаха | Род запаха | |
| Термины | Символы | |
| Ароматический | А | Огуречный, цветочный |
| Болотный | Б | Илистый, тинистый |
| Гнилостный | Г | Фекальный, сточный |
| Древесный | Д | Мокрой коры, древесной щепы |
| Землистый | З | Затхлый, застойный |
| Плесневый | П | Прелый, свежевспаханной земли |
| Рыбный | Р | Рыбы, рыбьего жира |
| Сероводородный | С | Тухлых яиц |
| Травянистый | Т | Свежей травы, снега |
| Неопределенный | Н | Естественный не подходящий под предыдущие определения |
Неестественные запахи от посторонних веществ, поступающих в водоемы, называют по наименованию веществ: ХЛОРНЫЙ, ФЕНОЛЬНЫЙ, БЕНЗИНОВЫЙ и др.
ОЦЕНОЧНЫЕ КРИТЕРИИ ЗАПАХА ВОДЫ
| Балл | Интенсивность запаха | Определение |
| Нет | Вовсе неощутимый | |
| Очень слабый | Обнаруживается в лаборатории, опытным деодоратором | |
| Слабый | Обнаруживается потребителем, если на запах обратить его внимание | |
| Заметный | Легко замечаемый и обращающий на себя внимание | |
| Отчетливый, сильный | Вода неприятна для питья | |
| Очень сильный | Вода непригодна для питья |
При определении запаха руки и одежда наблюдателя не должны ничем пахнуть (например духами и пр.), воздух помещения должен быть чистым.
Определение вкуса и привкуса питьевой воды
Различают четыре основных вкуса: СОЛЕНЫЙ, КИСЛЫЙ, ГОРЬКИЙ, СЛАДКИЙ.
Все другие ощущения называются привкусами. При исследовании испытуемую воду набирают в рот малыми порциями, не проглатывая, задерживая во рту 3-5 сек. Интенсивность вкуса и привкуса определяют по шестибалльной системе согласно требованиям таблицы.
ИНТЕНСИВНОСТЬ ВКУСА И ПРИВКУСА
| Интенсивность | Характер вкуса и привкуса | Оценка интенсивности в баллах |
| Нет | Вкус и привкус не ощущается | |
| Очень слабая | Вкус и привкус не ощущается потребителем, но обнаруживаются при лабораторном исследовании | |
| Слабая | Вкус и привкус замечаются потребителем, если обратить на это внимание | |
| Заметная | Вкус и привкус легко замечаются и вызывают неодобрительный отзыв о воде | |
| Отчетливая | Вкус и привкус обращают на себя внимание и заставляют воздержаться от питья | |
| Очень сильная | Вкус и привкус настолько сильный, что делает воду непригодной к употреблению |
Определение вкуса воды, производится только при наличии полной уверенности и безопасности воды (отсутствие ядовитых веществ и загрязнений бактериального происхождения), в противном случае вкус определяется после кипячения и охлаждения воды, что также отмечают в протоколе.
Определение прозрачности
Прозрачность зависит от наличия в ней взвешенных веществ. Прозрачность определяю в цилиндрах Генера по шрифту Снеллена. Испытания проводят в стеклянном цилиндре с плоским, хорошо отшлифованным дном. Цилиндр градуирован по высоте на 30 см с делением по 0,5 см и снабжен внизу трубкой (тубус со сливом), на который надевают резиновую трубку с зажимом. Под дном цилиндра на расстоянии 4 см помещен шрифт Снеллена № I. В цилиндр, находящийся на расстоянии не далее 1 метра от окна, после взбалтывания наливают испытуемую воду до края, затем медленно спускают ее через трубку до тех пор, пока станет возможным чтение шрифта. В этот момент определяют и записывают высоту воды в см. Полученную прозрачность испытуемой воды в см по таблице переводят в показатель мутности.
Определение цветности воды
Цветность воды определяется сравнением воды со стандартными эталонами цветности платиново-кобальтовой или хромово-кобальтовой шкал. Цветность этих шкал от 0 до 50°. При прозрачности ниже 20 см вода перед исследованием фильтруется, при цветности выше 80° - разбавляется дистиллированной водой. Для качественного определения цветности исследуемую воду выливают в такие же цилиндры, которые были использованы для приготовления стандартного эталона, а затем сравнивают окраску воды (испытуемой) сверху с эталоном. Результат цветности выражается в градусах.
Методика определения жесткости воды.
Жесткость воды зависит от содержания солей кальция и магния. Иногда она обусловливается также наличием солей закисного железа, марганца, аммония. Различают 3 вида жесткости:
· общую;
· постоянную;
· устранимую (временную).
ОБЩАЯ ЖЕСТКОСТЬ - это жесткость сырой воды, обусловленная всеми соединениями кальция и магния (иногда железа и марганца), независимо от того, с какими анионами связаны названные катионы.
ПОСТОЯННАЯ ЖЕСТКОСТЬ - жесткость после одночасового кипячения, зависящая от присутствия различных солей, не дающих осадка при кипячении. Главным образом это сульфаты и хлориды кальция и магния.
УСТРАНИМАЯ ЖЕСТКОСТЬ - это устранимая при кипячении жесткость, объясняется разрушением бикарбонатов солей кальция, меньше магния, а иногда железа и перевода их в нерастворимые углекислые соли (монокарбонаты), которые оседают на стенках сосудов в виде накипи (CaCO2, MgСО2).
Таким образом устранимая жесткость - есть часть общей жесткости, которую можно вычислить по разнице между общей и постоянной жесткостью.
Жесткость измеряется в миллиграмм-эквивалентах на литр (мг-экв/л).
ОПРЕДЕЛЕНИЕ ОБЩЕЙ ЖЕСТКОСТИ
Метод основан на способности трилона Б образовывать прочные комплексы с ионами кальция и магния.
Определение проводят титрованием пробы воды трилоном Б при рН 10 в присутствии индикатора. По количеству трилона Б, пошедшего на титрование взятого объема воды, определяют общую жесткость. В качестве индикатора применяют эрихром черный (хромоген черный специальный) или хромоген темно-синий кислотный. В щелочной среде в присутствии ионов кальция и магния первый индикатор (хромоген черный специальный) дает виннокрасное окрашивание второй - розовокрасное. В отсутствии их - соответственно синее с зеленоватым оттенком и синее с сиреневым оттенком.
ХОД ОПРЕДЕЛЕНИЯ
100 мл исследуемой воды наливают в коническую колбу, добавляют 5 мл аммиачно-буферного раствора и 5-7 капель индикатора. Титруют медленно при интенсивном помешивании 0,05 н раствором трилона Б до переходной окраски из виннокрасного в синий с зеленоватым оттенком.
Жесткость рассчитывают в мг-экв по формуле:
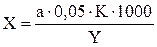 , где:
, где:
а - кол-во р-ра трилона Б в мл;
K - поправочный коэффициент к титру р-ра трилона Б;
Y - объем пробы воды, взятый для титрования, в мл;
1000 - пересчет мл в литры.
ПРИМЕЧАНИЕ: Если на титрование расходуется больше 10 мл р-ра трилона Б, необходимо взять меньший объем исследуемой воды и довести его дистиллированной водой до 100 мл. В расчет берется количество взятой пробы воды.
ЗАНЯТИЕ 2. МЕТОДЫ ОПРЕДЕЛЕНИЯ ПОКАЗАТЕЛЕЙ ОРГАНИЧЕСКОГО ЗАГРЯЗНЕНИЯ ВОДЫ И ИХ ГИГИЕНИЧЕСКАЯ ОЦЕНКА.
ЦЕЛЬ ЗАНЯТИЯ:
1. Изучить особенности антропогенного загрязнения воды
2. Освоить методы определения показателей органического загрязнения воды.
ОБЪЕМ САМОСТОЯТЕЛЬНОЙ РАБОТЫ
1. Определение содержания аммонийных солей (аммиака) в воде.
2. Определение содержания солей азотистой кислоты (нитритов) в воде.
3. Определение содержания солей азотной кислоты (нитратов) в воде.
4. Определение окисляемости исследуемой пробы воды.
5. Написание общего протокола по исследованной пробе воды и ее гигиеническая оценка по исследованным показателям.
КОНТРОЛЬНЫЕ ВОПРОСЫ
1. Эпидемиологическое значение воды.
2. Источники органического загрязнения воды.
3. Поведение органических веществ в воде.
4. Санитарно-гигиеническое значение показателей триады азота в воде и допустимые их количества в питьевой воде.
5. Принцип метода определения триады азота в воде.
6. Принцип метода определения окисляемости воды.
Азотсодержащие вещества являются важным показателем органического загрязнения воды, т.к. они образуются при разложении белковых веществ, попадающих в источники с хозяйственно-фекальными и промышленными отбросами. Аммиак - продукт белкового распада, поэтому его обнаружение свидетельствует о свежем загрязнении.
Нитриты указывают на некоторую давность загрязнения (время, необходимее для превращения аммиака в нитриты). Нитраты свидетельствуют о более давних сроках загрязнения. По азотсодержащим веществам можно судить о характере загрязнений водоисточников. Если в воде обнаружен аммиак, а при повторных анализах он отсутствует, то можно говорить о случайном загрязнении. Наличие в воде аммиака и нитритов свидетельствует о том, что вода ранее не загрязнялась, но сравнительно недавно появился постоянно действующий источник загрязнения. Обнаружение аммиака, нитритов и нитратов свидетельствует о явном неблагополучии водоисточника, подвергающегося постоянному загрязнению. Если в воде обнаруживаются нитраты, но нет аммиака, это указывает на то, что ранее существовал постоянно действующий источник загрязнения, а в настоящее время загрязнение источника не происходит. Наличие в воде аммиака и нитратов при отсутствии промежуточного продукта - нитритов, говорит о том, что водоисточник загрязняется периодически. Обнаружение нитратов говорит об окончании процессов минерализации.
Азотсодержащие вещества могут быть и минерального происхождения. Это следует особо учитывать при исследовании артезианских вод, В таких случаях необходимо обращать внимание на наличие других показателей загрязнения, особенно на бактериологические показатели и величины окисляемости. Последняя будет высокой без нагревания воды, что также свидетельствует о минеральном происхождении данного показателя.
Однако высокая окисляемость при кипячении воды говорит о наличии в ней органических загрязнений.
Определение азота аммиака (аммонийных солей) (качественное с приближенной количественной оценкой)
Азот аммонийных солей в питьевой воде качественно и количественно определяют с помощью реактива Несслера, который дает желтое окрашивание в присутствии солевого аммиака.
В пробирку налить 1/3 исследуемой воды, прибавить 2-3 капли раствора сегнетовой соли для удержания солей Ca и Mg и 5 капель реактива Несслера. Через 10 мин определяют содержание аммонийного азота по таблице 1
Определение азота нитритов
Принцип метода основан на образовании ярко окрашенных азокрасок при взаимодействии нитритов в кислой среде с реактивом Грисса. Наливают 1/2 пробирки испытуемой воды, прибавляет 10 капель реактива Грисса и нагревают на водяной бане 5 мин. Приближенное содержание определяют по таблице 2.
 2014-10-30
2014-10-30 3395
3395