Многие процессы выплавки сплавов завершаются операцией освобождения сплавов от избытка кислорода - раскислением. Удаление кислорода из оксида, растворенного в металлическом расплаве, или восстановление оксидов, находящихся в шлаке, определяет качество и свойства металла.
Для того чтобы произошло разложение оксида и выделение из него металла необходимо, чтобы упругость диссоциации оксида была больше парциального давления кислорода в газовой фазе, то есть
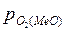 >
> 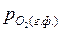 .
.
Вакуумирование пространства над расплавом не обеспечивает это условие. Более эффективным способом является химическое связывание кислорода с помощью элементов, обладающих большей степенью химического сродства к кислороду, чем восстанавливаемый металл. Оценить эффективность элементов-восстановителей, можно по величине изменения изобарно-изотермического потенциала 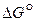 образования оксидов.
образования оксидов.
На практике в качестве восстановителей используют твёрдый углерод С, СО, Н 2, многокомпонентные газовые природные смеси и др.
Термодинамически процесс восстановления может быть представлен в виде совокупности двух обратимых реакций: взаимодействия металла и восстановителя с кислородом.
Если восстановителем является СО, то реакции имеют вид:
2 МеО↔ 2 Ме + О 2(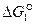 ),
),
2 СО 2 ↔ 2 СО + О 2(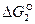 ).
).
Итоговая реакция получается при вычитании реакции 2 из реакции 1:
МеО + СО ↔ Ме + СО 2(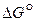 ).
).
Изобарно-изотермический потенциал итоговой реакции
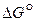 = ½ (
= ½ (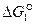 -
- 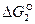 ).
).
Константы равновесия реакций 1 и 2:
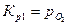 ,
, 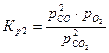 .
.
Завершенность реакции характеризуется равновесным состоянием газовой фазы.
Направление процесса и суммарный результат 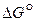 будут определяться соотношением величин
будут определяться соотношением величин 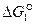 и
и 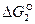 . Величина и знак
. Величина и знак 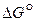 процесса определяются свойствами реагирующих оксидов и составом газовой фазы в начальном и конечном состояниях.
процесса определяются свойствами реагирующих оксидов и составом газовой фазы в начальном и конечном состояниях.
Если условия реагирования отличны от стандартных, то на величину 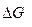 оказывает влияние исходный составов системы.
оказывает влияние исходный составов системы.
Условия протекания процессов в рассматриваемой системе:
1). Восстановление оксида, если 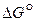 <0, т.е.
<0, т.е. 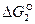 >
> 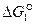 ;
;
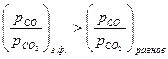 ;
; 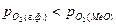 .
.
2). Окисление металла, если 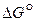 >0, т.е.
>0, т.е. 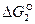 <
< 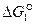 ;
;
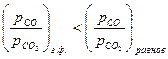 ;
; 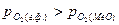 .
.
3). Равновесное состояние. 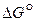 =0, т.е.
=0, т.е. 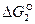 =
= 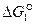 ;
;
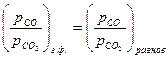 ;
; 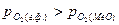 .
.
 2015-01-30
2015-01-30 2167
2167