Если катализаторы и реагенты находятся в разных фазах и имеют границу раздела, то катализ называется гетерогенным. Катализатор является твердым веществом, а реагирующие вещества – газы или жидкости. Реагирующие молекулы адсорбируются на поверхности катализатора, и за счет ориентации определенным образом и ослабления внутримолекулярных связей снижается энергия активации и увеличивается скорость реакции.
Пусть в отсутствии катализатора протекает реакция
А + В = АВ* = Продукты, а в присутствии катализатора скорость ее возрастает, но продукты остаются теми же. Если считать, что активное адсорбционное состояние аналогично активированному комплексу АВ некаталитической реакции, то весь процесс можно изобразить следующим образом.
1. Адсорбция исходных веществ на поверхность катализатора: А + В + Кт = АВКт
Как правило, этот процесс экзотермический.
2. Перевод адсорбированного состояния в активное: АВКт = АВКт*
Этот процесс требует затраты энергии, называемой истинной энергией активации.
3. Реакция в адсорбированном состоянии с образованием адсорбированных конечных продуктов:
АВКт* = Продукты Кт
4. Десорбция продуктов реакции, приводящая к регенерации катализатора: Продукты Кт = Продукты + Кт
Таким образом, и в гетерогенном катализе ускоряющее действие катализатора, так же как и в гомогенном катализе, связано с тем, что реагирующие вещества образуют промежуточные соединения, что приводит к снижению энергии активации.
Катализаторами называются вещества, изменяющие скорость химических реакций.
Одни катализаторы сильно ускоряют реакцию - положительный катализ, или просто катализ, другие - замедляют - отрицательный катализ. Примерами положительного катализа могут служить получение серной кислоты, окисление аммиака в азотную кислоту с помощью платинового катализатора и др.Примерами отрицательного катализа являются замедление взаимодействия раств-ора сульфита натрия с кислородом воздуха в присутствииэтилового спирта или уменьшение скорости разло-жения пероксидаводорода в присутствии небольших количеств серной кислоты (0,0001 мас. частей) и др.От-рицательный катализ часто называют ингибированием, а отрицательные катализаторы, снижающие скорост-ь реакции, -ингибиторами (механизм действия последних отличен от действия катализаторов).
Катализ - химическое явление, суть которого заключается в изменении скоростей химических реакций при действии некоторых веществ (их называют катализаторами).
Каталитические реакции весьма распространены в химии и некоторые из них можно провести даже в домашних условиях. Например, 3%-ный раствор перекиси водорода (именно такой продают в аптеках) вполне устойчив в отсутствие примесей. Но при добавлении очень небольшого количества (нескольких крупинок) твердого диоксида марганца MnO2 начинается реакция разложения Н2О2 с выделением газообразного кислорода:
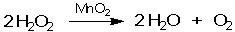
Здесь MnO2 - катализатор реакции.
Примером ингибиторов являются вещества, замедляющие коррозию металлов; они частично в результате адсорбции, частично в результате химических реакций образуют на обрабатываемой поверхности металлов защитные пленки. Ингибиторы применяются для предупреждения окисления жиров и смазочных масел, для замедления разложения малоустойчивых веществ, имеющих практически важное значение, в них добавляют стабилизаторы. Так, для пероксида водорода стабилизатором служат Ингибитор (лат. inhibere — задерживать) — вещество, замедляющее или предотвращающее течение какой-либо химической реакции: коррозии металла, старения полимеров, окисления топлива и смазочных масел, пищевых жиров и др.осфаты натрия, для некоторых красителей - хроматы металлов. Например, гидрохинон — ингибитор окисления бензальдегида; соединения технеция — ингибитор коррозии сталей; дифенилкетон — ингибиторполимеризации стирола; трихлорид азота — сильный ингибитор реакции хлора с водородом, одной тысячной доли процента достаточно для прекращения реакции
Каталитические яды, или контактные яды — вещества, вызывающие «отравление» катализатора, т. е. снижающие его каталитическую активность или полностью прекращающие каталитическое действие. Причина отравления заключается в адсорбции каталитического яда на поверхности катализатора. Различают следующие виды каталитического отравления:
— Каталитический яд может адсорбироваться на активном центре катализатора, препятствуя взаимодействию реагентов с этим активным центром. В данном случае наблюдается линейная зависимость снижения каталитической активности от количества введенного в систему яда.
Пример: действие хинолина на алюмосиликатные катализаторы при крекинге.
— Экранирование — яд может сильно отравить поверхность катализатора, что приведет к резкому снижению каталитической активности. В этом случае введение дополнительных доз яда будет снижать активность медленно.
Пример: разложение пероксида водорода на платиновом катализаторе при адсорбции яда — дихлорида ртути.
Случается, что в микродозах некоторый каталитический яд может служить и промотором, когда в больших количествах начинает действовать как яд. Данный вид действия принято называть модифицированием катализатора. В случае сложных каталитических реакций каталитические яды могут действовать избирательно — подавлять каталитическую активность в одних катализаторах и не влиять на другие. В некоторых случаях одни и те же вещества могут быть каталитическими ядами по отношению к одним реакциям и не влиять на другие.
Примеры каталитических ядов
К числу наиболее распространенных каталитических ядов принадлежат Н2О, СО, СО2, H2S, N, P, As, Sb и др.
Химические реакции, в результате которых исходные вещества практически полностью превращаются в конечные продукты, называются необратимыми.
К ним откосятся как гетерогенные, так и гомогенные реакции. Например, реакции горения простых веществ — фосфора, угля, железа и сложных — метана СН4, сероуглерода СS2. Как вы знаете, реакции горения относятся к экзотермическим реакциям. Чаще всего к экзотермическим будут относиться реакции соединения, например реакция гашения извести:
СаО + Н2О = Са(ОН)2 + Q (теплота выделяется).
Логично предположить, что к эндотермическим реакциям относятся обратные реакции, то есть реакции разложения, например реакция обжига известняка:
СаС03 = СаО + СО2 - Q (теплота поглощается).
Следует помнить, что очень небольшое число реакций являются необратимыми.
Реакции гомогенные (например, между растворами нешеств) являются необратимыми, если протекают с образованием нерастворимого, газообразного продукта или воды. Это правило называется правилом Еертолле, который и установил это важнейшее условие необратимости химической реакции. Химические реакции, которые протекают одновременно а двух противоположных направлениях — прямом и обратном — называются обратимыми.
В пробирку нальем 3 мл йоды и добавим несколько капель лакмуса, а затем начнем пропускать через нее с помощью гало отводной трубки выделяющийся из другой пробирки углекислый газ. получаемый взаимодействием мрамора и соляной кислоты. Через некоторое время мы заметим, как фиолетовый лакмус изменяет свою окраску на красную, что свидетельствует о наличии кислоты, Это непрочная угольная кислота, образовавшаяся в результате взаимодействия углекислого газа и воды:
СО2+ H2O = H2CO3
Оставим полученный раствор кислоты стоять в штативе. Через некоторое время мы увидим, что раствор снова стал фиолетовым, так как кислота разложилась на исходные вещества.
Это процесс можно провести гораздо быстрее, если подо треть раствор угольной кислоты. Следовательно, реакция получения угольной кислоты протекает как в прямом, так н в обратном направлении, то есть является обратимой. Обратимость реакции обозначается двумя противоположно направленными стрелками:
Среди обратимых реакций, лежащих в основе получения важнейших химических продуктов, в качестве примера назо вем реакцию синтеза (соединения) оксида серы (VI) из оксида серы (IV) и кислорода.
Условия химического равновесия
Химические реакции заключаются во взаимодействии реагентов с образованием продуктов. Не следует, однако, полагать,что направление химической реакции только одно (реагенты→продукты). В действительности, химические реакции протекают в прямом и обратном направлениях:Реагенты ↔ Продукты. Все химические реакции, в принципе, обратимы. Это означает, чтов реакционной смеси осуществляется как взаимодействие исходных реагентов (при этом образуются продукты), так и взаимодействие продуктов (при этом образуются исходные реагенты). В этом смысле различие между реагентамии продуктами чисто условное; оно определяется записью уравнения обратимой реакции: слева от знака обратимости↔ записывают формулы исходных реагентов, справа – формулы продуктов.
Кинетическое условие химического равновесия. Зависимость между прямой и обратной реакциями количественно выражается через скорость реакции. Скорость химической реакции зависит от числа реагирующих (т. е. соударяющихся) частиц. В первый момент протекания обратимой реакции синтеза аммиака N2 + 3H2 ↔ 2NH3 в системе содержатся только частицы исходных веществ (N2 и Н2). Поэтому в первый момент протекает только прямая реакция, причем с очень высокой скоростью. При появлении частиц конечных веществ (в синтезе аммиака – NH3) развивается обратная реакция, причем вначале с очень малой скоростью. По мере протекания прямой реакции накапливается все большее число частиц конечных веществ, которые принимают участие в обратной реакции, поэтому скорость обратной реакции все больше возрастает. Одновременно снижается число частиц исходных веществ, и скорость прямой реакции все больше уменьшается. В результате в реакционной системе достигается состояние, при котором скорости прямой и обратной реакций равны.Такое состояние реакционной системы называется состоянием химического равновесия. При химическом равновесии обе реакции, прямая и обратная, продолжают протекать, следовательно, это равновесие динамическое (а не статическое), или подвижное. Во всех обратимых реакциях скорость прямой реакции уменьшается, скорость обратной реакции возрастает до тех пор, пока обе скорости не станут равными и не установится состояние равновесия, когда υ пр =υ обр.
Термодинамическое условие химического равновесия. Рассмотрим обратимую реакцию:2Н2(г) +О2(г) ↔ 2Н2О(г), ∆rH0 < 0, ∆rS0 < 0.
Протекание реакции в прямом направлении сопровождаться выделением теплоты (∆rН0 < 0). Энтропия системы при этом уменьшается (∆rS0 < 0), так как в результате реакции из 3 молей газов образуются 2 моля газов. Таким образом, движущей силой этого процесса является энергетический (энтальпийный) фактор. Протекание рассматриваемой реакции в обратном направлении сопровождается поглощением теплоты (∆rН0 > 0); энтропия системы возрастает (∆rS0 > 0). Таким образом, движущей силой этого процесса является энтропийный фактор
 2015-01-30
2015-01-30 2733
2733
